
| 已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
| N2 | H2 | NH3 | ||
| 1 | 4 | 0 | a | |
| ① | 1.5 | 9 | 0 | >1.5a |
| ② | 0 | 0.5 | 1 | 0.5a |
| ③ | m | g(g≥4m) | 0 | am或者$\frac{ag}{4}$ |
分析 容积可变的密闭容器中,保持一定温度和压强,进行以下反应:N2(g)+3H2(g)?2NH3(g),把容器内的物质都转化为同种物质,如果与原来加入的量等比例,则为等效平衡,平衡时各组分的体积分数不变;据此分析.
解答 解:①已知加入1mol N2和4mol H2时,达到平衡后生成a mol NH3,根据等效平衡原理:加入1.5mol N2和9mol H2时,相当于在原反应物的起始量1.5倍的基础上再加入了3mol的H2,则平衡时NH3的量是原平衡的1.5倍基础上正向移动,即氨气的物质的量>1.5amol;
②若平衡时NH3的物质的量为0.5amol,则平衡时氨气的量是原来平衡氨气的物质的量的一半,所以起始时应加入0.5mol N2和2mol H2,已知起始时有氨气1mol,相当于有0.5mol N2和1.5mol H2所以还需0.5mol氢气,故起始时只需加入0.5molH2和1molNH3,
③若开始时加入m mol N2和gmol H2,则平衡是氨气的物质的量为:$\frac{1}{m}$=$\frac{a}{n(N{H}_{3})}$,则n(NH3)=am,或者$\frac{4}{g}$=$\frac{a}{n(N{H}_{3})}$,则n(NH3)=$\frac{ag}{4}$;
故答案为:>1.5a;0;0.5;am或$\frac{ag}{4}$.
点评 本题考查了化学平衡的计算,注意利用等效平衡原理解答,难度中等.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
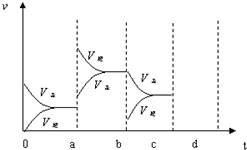 如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).
如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可逆反应的化学计量数数:a>b+c | |
| B. | 压缩容器的容积时,v正增大,v逆减小 | |
| C. | 达到新平衡时,Y,Z浓度增大,K值变大 | |
| D. | 达到新平衡时,加入物质X反应正动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C(s)+H2O(g)?CO(g)+H2(g)反应,在一定条件下达到平衡,增加或减少C(s)的量平衡不移动 | |
| B. | 对于2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 | |
| C. | 对于C(s)+CO2(g)?2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志 | |
| D. | 对于I2(g)+H2(g)?2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI的百分含量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为△H=-285.8 kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2 H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加醋酸 CO32-+2H+═H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+═H2O+CO2↑ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com