
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2,2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7,Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
分析 A.酸性HClO>HCO3-,反应生成次氯酸和碳酸氢根离子;
B.亚铁离子的还原性大于溴离子;
C.反应后溶液的pH=7,呈中性,则硫酸氢钾与氢氧化钡按照物质的量2:1反应;
D.酸性条件下,二者反应生成锰离子和水.
解答 解:A.已知电离平衡常数H2CO3>HClO>HCO3-,则酸性HClO>HCO3-,向NaClO溶液中通入少量CO2,反应生成的是次氯酸和碳酸氢根离子,正确的离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故A错误;
B.亚铁离子的还原性大于溴离子,向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸离子方程式为:Fe2++Br-+4H++NO3-═Br2+NO↑+2H2O+Fe3+,故B错误;
C.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7,硫酸氢钾和氢氧化钡按照物质的量2:1反应,反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C正确;
D.在酸性条件下,二者反应生成锰离子和水,正确的离子方程式为:6H++2MnO4-+5H2O2═2Mn2++5O2↑+8H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写,涉及氧化还原反应,明确离子反应先后顺序、反应实质是解本题关键,再结合原子守恒、电荷守恒、转移电子守恒等知识点来分析解答,题目难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 加热时,②、③中的溶液为无色,冷却后又都变红 | |
| C. | ④中,浸泡在热水中的容器内气体颜色变浅,浸泡在冰水中的容器内气体颜色变深 | |
| D. | 四个“封管实验”中不是都有可逆反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| D. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$ K↑+NaCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量未知溶液,分别滴加Ba(OH)2溶液,有沉淀生成的为Na2CO3溶液 | |
| B. | 取少量未知溶液,分别滴加CaCl2溶液,有沉淀生成的为Na2CO3溶液 | |
| C. | 分别滴加酚酞试液,红色较深的是NaHCO3溶液 | |
| D. | 取少量未知溶液,分别滴加过量稀HCl溶液,能产生气体的是NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.4mol/(L•s) | B. | v(B)=0.5mol/(L•s) | C. | v(C)=0.6mol/(L•s) | D. | v(D)=0.7mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度NaHSO4和Ba(OH)2两溶液等体积混合H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 在含有Mn2+的溶液中加入稀硝酸酸化,再加入PbO2反应体系显紫红色5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O | |
| C. | 硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | Na2O2投入H218O中:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
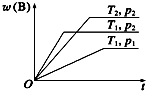 可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | a+b<c,正反应为放热反应 | B. | a+b<c,正反应为吸热反应 | ||
| C. | a+b>c,正反应为吸热反应 | D. | a+b>c,正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com