
【题目】25 ℃时,用浓度为0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )

A.相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ
B.根据滴定曲线可得,Ka(HX)=10-3 mol·L-1
C.滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+)
D.滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-)
【答案】D
【解析】本题考查酸碱中和滴定图像,意在考查考生通过识图获取信息的能力。氢氧化钠溶液的体积为0 mL时,0.100 0 mol·L-1的三种酸HX、HY、HZ的pH依次减小,故酸性强弱为HX<HY<HZ,A项错误;0.1000 mol·L-1HX的pH=4,HX![]() H++X-,c(H+)=10-4 mol·L-1,c(X-)=10-4 mol·L-1,c(HX)≈0.100 0 mol·L-1,Ka(HX)=
H++X-,c(H+)=10-4 mol·L-1,c(X-)=10-4 mol·L-1,c(HX)≈0.100 0 mol·L-1,Ka(HX)=![]() =10-7 mol·L-1,B项错误;0.100 0 mol·L-1 HY溶液的pH约为3,故HY为弱酸,当NaOH溶液体积为20 mL时,恰好完全反应生成NaY,Y-水解使溶液显碱性,c(Na+)>c(Y-)>c(OH-)>c(H+),C项错误;0.100 0 mol·L-1 HZ溶液的pH=1,故HZ为强酸,当NaOH溶液体积为15 mL时,溶液显酸性,即c(H+)>c(OH-),又因溶液中存在电荷守恒:c(H+)+c(Na+)=c(Z-)+c(OH-)。故有:c(Z-)>c(Na+)>c(H+)>c(OH-),D项正确。
=10-7 mol·L-1,B项错误;0.100 0 mol·L-1 HY溶液的pH约为3,故HY为弱酸,当NaOH溶液体积为20 mL时,恰好完全反应生成NaY,Y-水解使溶液显碱性,c(Na+)>c(Y-)>c(OH-)>c(H+),C项错误;0.100 0 mol·L-1 HZ溶液的pH=1,故HZ为强酸,当NaOH溶液体积为15 mL时,溶液显酸性,即c(H+)>c(OH-),又因溶液中存在电荷守恒:c(H+)+c(Na+)=c(Z-)+c(OH-)。故有:c(Z-)>c(Na+)>c(H+)>c(OH-),D项正确。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 离子化合物中只能含离子键,不能有共价键
B. 所有非金属之间形成的化学键一定是共价键
C. 电子数相同的两种微粒一定是同一元素
D. 判断化学变化的可靠方法是看有无化学键的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中和滴定操作过程中,有以下各项因操作不当而引起的实验误差,用“偏高”“偏低”或“无影响”等填空::
(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 。
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果 。
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果 。
(4)滴定前平视,滴定终点俯视滴定管刻度 ,使滴定结果 。
(5)用NaOH溶液滴定盐酸(酚酞作指示剂),当加入一滴NaOH溶液时溶液呈浅红色,此时便停止滴定,使滴定结果 。
(6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。
(7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。
(8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
A(g)+2B(g)2C(g)+2D(l)△H=﹣250kJmol﹣1 K=0.2L/mol
(1)写出该反应平衡常数的表达式: .
(2)该反应的逆反应的△H= , 该反应的逆反应的K= .
(3)对该反应而言,升高温度,平衡常数将;增大压强,平衡常数将 . (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子,则下列描述正确的是( )
A.该溶液可能是由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成的
B.该溶液可能是由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成的
C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH![]() )之和
)之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 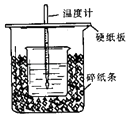
(1)观察实验装置,图中尚缺少的一种玻璃用品是 .
(2)大烧杯上如不盖硬纸板,测得的中和热的数值(填“偏大”、“偏小”或“无影响”).
(3)实验过程中倒入NaOH溶液的正确操作是 .
a.沿玻璃棒缓慢倒入 b.分多次少量倒入 c.一次迅速倒入
(4)实验中改用55mL 0.50mol/L盐酸与55mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求的中和热(填“相等”或“不相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol/L NH4Cl溶液中,NH4+的数目小于NA
B.常温常压下,8g CH4含有电子数目5NA
C.12g NaHSO4晶体中含有0.2 NA个阳离子
D.78g苯含有C=C双键的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20 mL 0.01 mol·L-1 KCl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1 HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是( ) 
A.该反应的热化学方程式M(g)+3N(g)2R(g)△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com