
已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625 kJ·g-1。下列热化学方程式中不正确的是( )
A.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH =-890 kJ/mol
CO2(g)+2H2O(l) ΔH =-890 kJ/mol
B.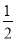 CH4(g)+O2(g)
CH4(g)+O2(g)
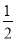 CO2(g)+H2O(l) ΔH=-445 kJ/mol
CO2(g)+H2O(l) ΔH=-445 kJ/mol
C.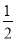 CO2(g)+H2O(l)
CO2(g)+H2O(l)
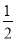 CH4(g)+O2(g) ΔH=+445 kJ/mol
CH4(g)+O2(g) ΔH=+445 kJ/mol
D.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-55.625 kJ/mol
CO2(g)+2H2O(l) ΔH=-55.625 kJ/mol
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素有关性质或结构信息
A负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9%
BB原子得到一个电子后3p轨道全充满
CC原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X
DD元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体
EE元素的核电荷数等于A元素和B元素氢化物的核电荷数之和
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)。
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈 (填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性 (填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,
写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
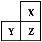
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.Y和Z的最高价氧化物对应水化物均为强酸
D.若Z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题6原子结构化学键练习卷(解析版) 题型:选择题
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5 NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
C.NH5的电子式为 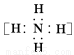 +
+
D.它与水反应的离子方程式为NH4++H-+H2O NH3·H2O+H2↑
NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:选择题
在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1
NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题4氧化还原反应练习卷(解析版) 题型:填空题
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+ Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 。
(2)写出CuH在氯气中燃烧的化学反应方程式
(3)CuH溶解在稀盐酸中生成的气体是 ,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题4氧化还原反应练习卷(解析版) 题型:选择题
根据表中信息,判断下列叙述中正确的是( )
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① |
| FeBr2 | / |
| Cl- |
② | KClO3 | 浓盐酸 | / | Cl2 |
|
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+ 2Mn2++4O2↑+6H2O
2Mn2++4O2↑+6H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题2化学计量及其应用练习卷(解析版) 题型:填空题
甲乙两位同学分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为 。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是
若定容时仰视刻度线,则所配溶液浓度 (填“偏大”、“偏小”或“无影响”)。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是 。
③定容的正确操作是 。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是 (填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
(3)乙学生:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com