
电池是人类生产和生活中重要的能量来源.各式各样电池的发明是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
|
| A. | 锌锰干电池工作一段时间后碳棒变细 |
|
| B. | 氢氧燃料电池可将热能直接转变为电能 |
|
| C. | 氢氧燃料电池工作时氢气在负极被氧化 |
|
| D. | 太阳能电池的主要材料是高纯度的二氧化硅 |
考点:
常见化学电源的种类及其工作原理.
专题:
电化学专题.
分析:
A、根据锌锰干电池的正极是碳棒,该极上二氧化锰发生得电子的还原反应;
B、氢氧燃料电池是将化学能转化为电能的装置;
C、氢氧燃料电池中,燃料做负极发生失电子的氧化反应;
D、太阳能电池的主要材料是半导体硅.
解答:
解:A、在锌锰干电池中,正极是碳棒,该极上二氧化锰发生得电子的还原反应,该电极质量不会减少,故A错误;
B、氢氧燃料电池属于原电池的一种,是将化学能转化为电能的装置,不可将热能直接转变为电能,故B错误;
C、氢氧燃料电池中,燃料做负极,发生失电子的氧化反应,被氧化,故C正确;
D、太阳能电池的主要材料是半导体硅,不是二氧化硅,故D错误.
故选C.
点评:
本题考查锌锰干电池以及氢氧燃料电池的有关知识,属于基本知识的考查,难度不大.


科目:高中化学 来源: 题型:
(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是 .
②既属于化合反应,又是氧化还原反应的是 .
③不属于四种基本反应类型的氧化还原反应的是 .
A.(NH4)2SO3 2NH3↑+H2O+SO2↑ B.2CO+O2
2NH3↑+H2O+SO2↑ B.2CO+O2 CO2
CO2
C. 2C+SiO2 Si+2CO↑ D.NH4NO3
Si+2CO↑ D.NH4NO3 N2O+2H2O
N2O+2H2O
E.CaCO3+CO2+H2O=Ca(HCO3)2F.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)在氧化还原化学反应中(2CuO+C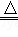 2Cu+CO2),物质所含元素化合价升高,这种物质是 剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
2Cu+CO2),物质所含元素化合价升高,这种物质是 剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
(3)鲜榨苹果汁是人们喜爱的饮料.由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色Fe3+.这个变色的过程中的Fe2+被 (“氧化”或“还原”).若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生.这说明维生素C有 (“氧化”或“还原”)性.
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe2+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0. 02 mol气体,同时产生沉淀;过滤、洗涤、灼烧,得到1.6 g红棕色固体;向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在4种离子
B.Cl– 一定存在,且c(Cl )≥0.4 mol/L
C.SO42–、NH4+,一定存在,Cl–可能不存在
D.CO32–、Al3+ 一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语的使用正确的是
A.硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I-+O2+2H2O==2I2+4OH-
 B.钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O==4OH-
B.钢铁发生吸氧腐蚀时,正极的电极反应式:O2+4e-+2H2O==4OH-
C.氨气催化氧化生产硝酸的主要反应: 4NH3+3O2 2N2↑+6H2O
D.向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O===H2SiO3+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
阿斯巴甜作为强烈甜味剂被广泛应用于食品、饮料、糖果等,
 工业上可以用苯丙氨酸甲酯和α-氨基丁二酸为原料合成:
工业上可以用苯丙氨酸甲酯和α-氨基丁二酸为原料合成:
已知:RCN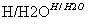 RCOOH;
RCOOH;

 。
。
(1)A中含氧官能团的名称为________________;α-氨基丁二酸的分子式为 。
(2)①、⑤的反应类型依次为 。
(3)B的同分异构体中同时符合下列条件的有2种,写出其结构简式:________________、_______________。
①有三种化学环境不同的氢原子;②含苯环的中性物质。
(4)写出阿斯巴甜与足量NaOH水溶液充分反应的化学方程式:__________________________________。
(5)写出以1,3-丙二醇(HOCH2—CH2—CH2OH)为原料制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
CH2===CH2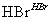 CH3CH2Br
CH3CH2Br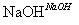 CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量.化学反应就是旧键的断裂和新键形成的过程.现查得:H﹣H、Cl﹣Cl和H﹣Cl的键能分别为436KJ/mol、243KJ/mol和431KJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应( )
|
| A. | 放热183KJ | B. | 放热91.5KJ | C. | 吸热183KJ | D. | 吸热91.5KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
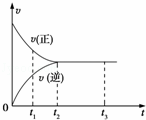
如图中是可逆反应X2+3Y2⇌2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
|
| A. | t1时,只有正方向反应 |
|
| B. | t1~t2,X2的物质的量越来越多 |
|
| C. | t2~t3,反应不再发生 |
|
| D. | t2~t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
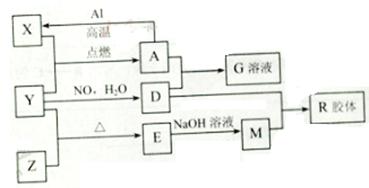
图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 ;R的化学式是 。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为 。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式:
。
(4)写出A和D的稀溶液反应生成G的离子方程式:
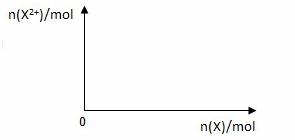
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的腐蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)_______________;在电化学腐蚀中,负极反应是_______________;正极反应是_______________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_______________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是_______________(答两种方法)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com