
| A�� | Na202������H20��Ӧ���ɱ����11.2L 02��ת�Ƶ��ӵ���ĿΪ2NA | |
| B�� | ��״���£�2.24L S03������������Ϊ4NA | |
| C�� | �ö��Ե缫���CuS04��Һ���������0.1mol Cu��0H��2��ʹ��Һ��ԭ�����·��ת�Ƶ��ӵ���ĿΪ0.2NA | |
| D�� | 0���101kp�������£�1.12L������ȫȼ�����ɵ�ˮ������Ϊ0.1NA |
���� A��������������Ԫ�صĻ��ϼ�Ϊ-1�ۣ���״����11.2L���������ʵ���Ϊ0.5mol��ת�Ƶ���Ϊ1mol��
B����״�������������״̬�������壻
C�����ݵ��صĹ���ԭ����Ҫ���õ���ĵ���ʸ�ԭ������ѭ��ԭ���ǣ���ʲô��ʲô������ Cu��OH��2����Һ����ǰ��ͬ��Cu��OH��2������Ͽɿ���CuO•H2O������ʵ�����൱�ڼ��������������ͭ��ˮ��
D��������Ϊ��״���£�1.12L��������ʵ���Ϊ0.05mol������HԪ���غ�ɼ��������ˮ�����ʵ�����
��� �⣺A��Na202������H20��Ӧ���ɱ����11.2L 02�����������ʵ���Ϊ0.5mol��������������Ԫ�صĻ��ϼ�Ϊ-1�ۣ���Ӧת�Ƶ��ӵ����ʵ���Ϊ��0.5mol��2[0-��-1��]=1mol��ת�Ƶ��ӵ���ĿΪNA����A����
B����״�����������������壬����ʹ�ñ�״���µ�����Ħ��������㣬��B����
C������0.1 mol Cu��OH��2��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH��Cu��OH��2������Ͽɿ���CuO•H2O�����ݡ�����ʲô����ʲô����ԭ��֪������������������ͭ��ˮ��������������������ͭ������0.1molͭת�Ƶ���=0.1mol��2mol=0.2mol������ԭ���غ�֪������0.1molˮ��Ҫ0.1mol����������0.1mol����ת�Ƶ���=0.1mol��2mol=0.2mol�����Ե������й�ת�Ƶ�����Ϊ0.4mol����·��ת�Ƶ��ӵ���ĿΪ0.4NA����C����
D��0���101kp��������Ϊ��״���£�1.12L��������ʵ���Ϊ0.05mol��0.05mol������ȫȼ������0.1molˮ����ȫȼ�����ɵ�ˮ������Ϊ0.1NA����D��ȷ��
��ѡD��
���� ���⿼�鰢���ӵ��������ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ�ע����ȷ��״��������Ħ�������ʹ���������������������ʵ���Ϊ���ĵĸ���ѧ���밢���ӵ������Ĺ�ϵ����������������ѧ�������������������ѧ��������û���֪ʶ���ʵ�������������


 �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д� ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{{K}^{+}}{K}$ | B�� | $\frac{Mg}{Ca}$ | C�� | $\frac{{O}^{2-}}{N{a}^{+}}$ | D�� | $\frac{Cl}{C{l}^{-}}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
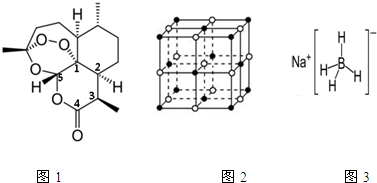
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ba��N03��2��Һ����CaCl2��Һ�ͣ�NH4��2SO4��Һ | |
| B�� | ��ϡ�������̼���ƹ����̼��ع��� | |
| C�� | ��ʪ�����ɫʯ����ֽ������������ | |
| D�� | �õ�����Һ����ӵ��Σ���KI03����δ�ӵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

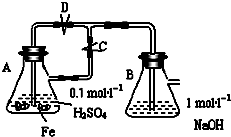
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ����˫Ӯ�Ŀ��⣮
�о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ����˫Ӯ�Ŀ��⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
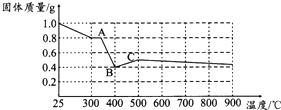 �����������壨FeC2O4•2H2O���ʵ���ɫ��ij������Ϊ̽������ҵ������Ļ�ѧ���ʣ�������һϵ��ʵ��̽����
�����������壨FeC2O4•2H2O���ʵ���ɫ��ij������Ϊ̽������ҵ������Ļ�ѧ���ʣ�������һϵ��ʵ��̽����| ʵ�鲽�裨��Ҫ��д������������̣� | Ԥ��ʵ������ͽ��� |
| ȡ������ɫ���壬��������ϡ���ᣨ��ϡ���ᣩ�ܽ⣬����Һ�м���KSCN��Һ | ����Һ�����ɫ�������һ����������Һ���ɫ�������һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com