
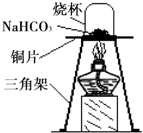
 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. | ||
| 固体产物是NaOH,而不是Na2CO3. |
| 实验操作 | 预期现象 | 结论 |
| 取样,加入适量的稀盐酸 | 有气泡产生 | 固体产物是Na2CO3,而不是NaOH |
| 取样,加入适量的稀盐酸 | 没有气泡产生 | 固体是产物NaOH,而不是Na2CO3 |
| 实验操作 | 预期现象 | 结论 |
| 取样,加入适量的稀盐酸 | 有气泡产生 | 固体产物是Na2CO3,而不是NaOH |
| 取样,加入适量的稀盐酸 | 没有气泡产生 | 固体是产物NaOH,而不是Na2CO3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
| B、将铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| C、铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ |
| D、实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol N2、3mol H2 | 4mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ |
| 气体密度 | ρ1 | ρ2 |
| 反应物转化率 | α1 | α2 |
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大力发展火力发电,解决浙江电力紧张问题,有利于发展节能减排、低碳经济 |
| B、从海带中提取碘单质的过程涉及氧化还原反应 |
| C、海洋经济专属区的资源开发可获得Na、Mg、K等金属 |
| D、可大力发展氯碱工业,建成氯碱、造纸、肥皂、玻璃、高纯硅等“资源-产品-再生资源”的产业链,走循环经济道路 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Abc]5g18s2 |
| B、[Abc]8s28p1 |
| C、[Abc]7d18s2 |
| D、[Abc]6f18s2 |
| E、[Abc]6f18s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、逐渐变大 | B、.逐渐变小 |
| C、.不变 | D、.无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、NOx、CO2、固体颗粒物同为大气污染物 |
| B、SO2对环境的主要影响是容易形成光化学烟雾,危害市民健康 |
| C、收集的酸雨在放置一段时间后pH会增大 |
| D、臭氧层是地球生命的保护伞,氟氯烃在破坏臭氧层时起到催化剂作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com