
分析 根据c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$计算溶液物质的量浓度;溶液具有均一性,溶液浓度与溶液体积无关;取出的溶液体积是原溶液体积的$\frac{1}{500}$,则这1mL溶液中溶质的质量是原溶质质量的$\frac{1}{500}$,溶液稀释前后溶质的物质的量不变,据此计算稀释后溶液物质的量浓度.
解答 解:c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{\frac{20g}{40g/mol}}{0.5L}$=1mol/L;溶液具有均一性,溶液浓度与溶液体积无关,所以取出溶液浓度为1mol/L;取出的溶液体积是原溶液体积的$\frac{1}{500}$,则这1mL溶液中溶质的质量是原溶质质量的$\frac{1}{500}$,则取出溶液中溶质的质量=20g×$\frac{1}{500}$=0.04g,溶液稀释前后溶质的物质的量不变,稀释后溶液物质的量浓度=$\frac{1mol/L×0.001L}{0.1L}$=0.01mol/L,
故答案为:1;1;0.04;0.01.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析计算能力,明确溶液浓度特点及物质的量有关公式是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与稀盐酸反应:H++OH-=H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钠溶液与稀盐酸反应:Na2CO3+2H+=2Na++H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与其他分散系最本质的区别是分散质粒子的直径介于1-100 nm之间 | |
| B. | 胶体和溶液都一定是均一透明的分散系,可以用丁达尔效应来鉴别 | |
| C. | 制备Fe(OH)3胶体的操作为,在沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热 | |
| D. | 用过滤的方法可以将胶体和溶液分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75mL 2mol•L-1FeCl3溶液 | B. | 25mL 2mol•L-1KCl溶液 | ||
| C. | 150mL 1mol•L-1NaCl溶液 | D. | 20mL 1.5mol•L-1 MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
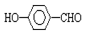 的沸点比
的沸点比 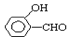 高,原因是:
高,原因是: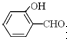 形成分子内氢键,而
形成分子内氢键,而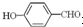 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X一定为电解质 | B. | X可能为NaCl | ||
| C. | X不能是酸类 | D. | X可以是任何化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com