
【题目】砷(As)元素及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态As原子的核外电子排布式为_____,砷与硒的第一电离能较大的是_____。
(2)传统中药的砷剂俗称“砒霜”,其分子结构如图所示,该化合物中As、O原子的杂化方式分别为____、_____。

(3)Na3AsO4可作杀虫剂。![]() 的立体构型为____,与其互为等电子体的分子的化学式为_____(任写一种)。
的立体构型为____,与其互为等电子体的分子的化学式为_____(任写一种)。
(4)H3AsO4和H3AsO3是砷的两种含氧酸,请根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因_____。
【答案】1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 As 或砷 sp3杂化 sp3杂化 正四面体形 CF4或 SiF4、CCl4、SiCl4 H3AsO4 和 H3AsO3 可分别表示为(HO)3AsO 和(HO)3As,H3AsO3 中 As 为+3 价,而 H3AsO4 中 As为+5 价,正电性更高,导致 As—O—H 中 O 的电子向 As 偏移,更易电离出 H+
【解析】
(1)As是33号元素,位于第四周期第VA族,据此书写基态As原子核外电子排布式;同周期中第一电离能第ⅤA族>第ⅥA族,据此判断;
(2)根据图片知,每个As原子能形成3个共价键、每个O原子能形成2个共价键,根据价层电子对互斥理论确定原子杂化方式;
(3)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)× ![]() =0,为sp3杂化;等电子体的原子数和价电子数(或电子总数)相同;
=0,为sp3杂化;等电子体的原子数和价电子数(或电子总数)相同;
(4)比较非羟基氧的多少,结合As原子化合价判断,非羟基氧越多、As化合价越高则酸性越强。
(1)As是33号元素,位于第四周期第VA族,基态As原子核外电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;同周期电离能第ⅤA族>第ⅥA族,所以砷的第一电离能大于硒,故答案为:1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;砷;
(2)根据分子结构可知,分子内含有6个氧原子,4个砷原子,化学式为As4O6,每个As原子形成3个共价键,又因为中心原子As上还有1对孤电子对,所以采用sp3杂化,每个O原子形成2个共价键,又因为中心原子O上还有2对孤电子对,所以采用sp3杂化,故答案为:sp3杂化;sp3杂化;
(3)AsO43-中As原子价层电子数为4+![]() =4、含有的孤电子对数是0,所以其构型是正四面体形,AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为CF4、SiF4、CCl4、SiCl4等,故答案为:正四面体; CF4或SiF4、CCl4、SiCl4;
=4、含有的孤电子对数是0,所以其构型是正四面体形,AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为CF4、SiF4、CCl4、SiCl4等,故答案为:正四面体; CF4或SiF4、CCl4、SiCl4;
(4)H3AsO4和H3AsO3可分别表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子向As偏移,更易电离出H+,故答案为:H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子向As偏移,更易电离出H+。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.少量碳酸氢钠溶液逐滴加入到氢氧化钙溶液中:![]()
B.在溴化亚铁溶液中通入过量的氯气:![]()
C.在NaHSO4溶液中滴入Ba(OH)2溶液至中性:![]()
D.少量二氧化硫通入漂白粉溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气还原氮氧化物的反应为:
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___。(用含△H1、△H2的式子表示)
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____。
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0,测得相关数据如表:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/molL1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/molL1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①05min,用NO2的浓度变化表示的反应速率为______。
②以下表述能说明该反应己达到平衡状态的是_____。
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡___(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=____。
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
离子 | NO3 | NO2 | Cl |
c/(molL1) | 2.0×104 | 1.0×104 | 1.75×104 |
①NaClO2溶液显碱性,用离子方程式解释原因_____。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。在![]() 密闭容器内,
密闭容器内,![]() 时反应:
时反应:![]()
![]() ,体系中
,体系中![]() 随时间的变化如下表:
随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示![]() 的变化的曲线是________。
的变化的曲线是________。
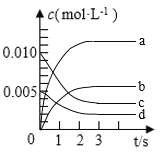
(2)用![]() 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率![]() ________
________![]() 。
。
(3)能说明该反应已达到平衡状态的是________。
a.![]() 与
与![]() 的浓度保持不变 b.容器内密度保持不变
的浓度保持不变 b.容器内密度保持不变
c.容器内压强保持不变 d.每消耗![]() 的同时有
的同时有![]() 形成
形成
(4)已知常温常压下1g液态甲醇燃烧生成![]() 气体和液态水放出
气体和液态水放出![]() 的热量,则该反应的热化学方程式为________。
的热量,则该反应的热化学方程式为________。
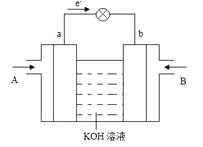
(5)![]() 与
与![]() 的反应可将化学能转化为电能,其工作原理如下图所示,图中
的反应可将化学能转化为电能,其工作原理如下图所示,图中![]() 从________(填A或B)通入。b电极反应式为________。
从________(填A或B)通入。b电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与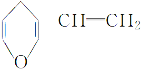 互为同分异构体的芳香化合物有6种
互为同分异构体的芳香化合物有6种
C. 青蒿素 ![]() 的一氯取代物有(不含立体异构)有7种
的一氯取代物有(不含立体异构)有7种
D. 菲的结构简式为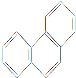 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++2OH-=Cu(OH)2↓
D.Na2O2是重要的供氧剂:2Na2O2+2H2O=4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热法是铝与某些金属氧化物反应获得高熔点金属单质的方法。工业上可用于制造无碳或低碳铁合金。铝粉和赤铁矿发生铝热反应的化学方程式为:Fe2O3+2Al![]() 2Fe+Al2O3。
2Fe+Al2O3。
(1)上述反应中,作为氧化剂的物质是__,化合价升高的元素是__。
(2)若反应中消耗了0.2molAl,生成Fe的物质的量为__mol,转移电子的物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生反应:![]()
![]() 实验测得有关数据如下表所示:
实验测得有关数据如下表所示:
容器编号 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化/kJ | ||
|
|
| ||
甲 | 2 | 1 | 0 |
|
乙 | 1.8 | 0.9 | 0.2 |
|
丙 | 0 | 0 | 2 |
|
下列判断中正确的是( )
A.![]()
B.若升高温度,反应的热效应不变
C.![]()
D.生成![]() 时放出的热量大于98.5 kJ
时放出的热量大于98.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是()

A. 该装置中铜为正极
B. 电池工作时H+向Cu电极移动
C. GaN 电极表面的电极反应式为: 2H2O-4e-═O2+4H+
D. 反应CO2+2H2O═CH4+2O2中每消耗 1mol CO2转移 4mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com