
| A. | 在一定条件下,反应CO(g)+2H2(g)?CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 | |
| B. | 常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol/L | |
| C. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| D. | 已知某温度下:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L K2CrO4溶液,则先产生Ag2CrO4沉淀 |
分析 A、根据平衡常数进行分析解答,平衡常数k=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$,温度不变平衡常数不变,充入适量氢气,增大容器的体积,维持H2浓度与温度不变,则$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$不变,故容器内甲醇、CO的物质的量不变,据此解答;
B、常温下,pH=2的CH3COOH溶液中c(CH3COOH)>0.01mol/L;pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后得到醋酸钠溶液,根据CH3COO守恒,分析解答;
C、对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-、CrO42-开始沉淀时c(Ag+)各是多少.
解答 解:A、平衡常数k=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$,温度不变平衡常数不变,充入适量氢气,增大容器的体积,维持H2浓度与温度不变,则$\frac{c(C{H}_{3}OH)}{c(CO)}$不变,故容器内甲醇、CO的物质的量不变,故CO的转化率不变,故A正确;
B、常温下,pH=2的CH3COOH溶液中c(CH3COOH)>0.01mol/L,所以设氢氧化钠的体积为1L,则醋酸体积小于1L,所以c(CH3COO-)+c(CH3COOH)>0.005mol/L,故B错误;
C、已知酸性:CH3COOH>H2CO3>Al(OH)3,所以水解程度:NaAlO2>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaAlO2<NaHCO3<CH3COONa,三份溶液中的c(Na+):①>②>③,故C错误;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{O}_{4}^{2-})}}$=4.36×10-5 mol/L,故先产生AgCl沉淀,故D错误;
故选A.
点评 本题考查化学平衡常数、盐的水解和溶度积常数的有关计算、判断离子是否完全,沉淀等问题,综合性强,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | C和O2 | B. | Na2CO3和盐酸 | C. | Na和O2 | D. | NaHCO3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
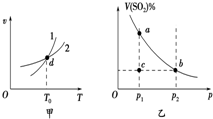
| A. | 图甲中,曲线1表示正反应速率和温度的关系,曲线2表示逆反应速率与温度的关系 | |
| B. | 图乙中,温度恒定时,a、b两点对应的反应速率:va>vb | |
| C. | 图甲中,d点表示温度为T0时,反应已经达到平衡 | |
| D. | 图乙中,温度恒定时,c点的反应正在向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热 | B. | 加入催化剂 | C. | 减小压强 | D. | 增加C的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 橄榄石中铁为+2价 | |
| C. | 月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 | |
| D. | 斜长石的氧化物形式可表示为:K2O•Al2O3•3SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中,加入KCl固体,溶液颜色加深 | |
| B. | 对2NO2?N2O4的平衡体系增大压强,平衡后气体颜色变浅 | |
| C. | 对H2(g)+I2(g)?2HI(g)的平衡体系增大压强,容器内气体颜色变深 | |
| D. | 向滴有石蕊的醋酸溶液中通入HCl气体,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Fe参与负极反应,NiO2参与正极反应 | |
| B. | 充电时,阴极上的电极反应式为:Fe(OH)2+2e-═Fe+2OH- | |
| C. | 蓄电池的电极必须浸入某种碱性电解质溶液中 | |
| D. | 放电时,电解质溶液中的阴离子向正极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 金刚石和石墨 | ||
| C. | CH3CH=CH2和环丙烷 | D. | 丁烷和异丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com