
【题目】有机化合物J 是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。化合物J的一种合成路线如下:

已知:① A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4种氢,目峰面积之比为1:2:2:1。
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③![]()
回答下列问题:
(1)A的化学名称是_______,A+D→E的反应类型是_______。
(2)C→D的化学方程式是______________。
(3)化合物G中官能团的名称是______。
(4)鉴定I分子结构中官能团的光谱分析方法是__________。
(5)符合下列条件的E的同分异构体的数目有______种。
①能发生水解反应 ② 苯环上只有两个对位取代基 ③ 与FeCl3溶液发声显色反应
(6)以有机物B为原料,结合题设合成路线,写出制备l,3一丁二醇的转化流程图(无机化合物原料任选)________________。
【答案】 对羟基苯甲醛(4-羟基苯甲醛) 加成反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 碳碳双键、羟基、羧基 红外光谱 6
2CH3CHO+2H2O 碳碳双键、羟基、羧基 红外光谱 6 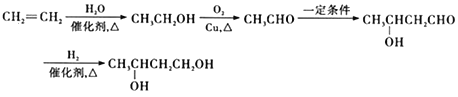
【解析】有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平,则B为CH2=CH2,与水发生加成反应生成C为CH3CH2OH,CH3CH2OH发生氧化反应得到的D为CH3CHO,A既能发生银镜反应,又能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,其核磁共振氢谱显示有4种氢,且峰面积之比为1:2:2:1,根据A的分子式可知,A为![]() ,A与D发生题中信息中的反应生成E为
,A与D发生题中信息中的反应生成E为![]() ,E发生氧化反应生成F为
,E发生氧化反应生成F为![]() ,F在浓硫酸作用下发生消去反应生成G为
,F在浓硫酸作用下发生消去反应生成G为![]() ,根据J分子结构中含有3个六元环可知,G与氯化氢发生加成反应,氯原子加在羧基邻位碳上,生成H为
,根据J分子结构中含有3个六元环可知,G与氯化氢发生加成反应,氯原子加在羧基邻位碳上,生成H为![]() ,H在碱性条件下发生水解生成I为
,H在碱性条件下发生水解生成I为![]() ,两分子I在浓硫酸作用下发生成酯化反应,生成环酯J为
,两分子I在浓硫酸作用下发生成酯化反应,生成环酯J为![]() ,则
,则
(1)根据以上分析可知A的化学名称是对羟基苯甲醛,A+D→E的反应类型是加成反应。(2)C→D的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O。(3)化合物G的结构简式为
2CH3CHO+2H2O。(3)化合物G的结构简式为![]() ,含有的官能团的名称是碳碳双键、酚羟基和羧基。(4)鉴定I分子结构中官能团的光谱分析方法是红外光谱。(5)E的同分异构体,符合以下要求①能发生水解反应,说明有酯基;②苯环上只有两个对位取代基;③与FeCl3溶液发生显色反应,说明有酚羟基,则另一个取代基是-CH2CH2OOCH、-CH(CH3)OOCH、-CH2OOCCH3、-OOCCH2CH3、-COOCH2CH3或-CH2COOCH3,符合条件的E的同分异构体有6种;(6)以有机物B为原料,结合题设合成路线和逆推法可知制备l,3一丁二醇的转化流程图为
,含有的官能团的名称是碳碳双键、酚羟基和羧基。(4)鉴定I分子结构中官能团的光谱分析方法是红外光谱。(5)E的同分异构体,符合以下要求①能发生水解反应,说明有酯基;②苯环上只有两个对位取代基;③与FeCl3溶液发生显色反应,说明有酚羟基,则另一个取代基是-CH2CH2OOCH、-CH(CH3)OOCH、-CH2OOCCH3、-OOCCH2CH3、-COOCH2CH3或-CH2COOCH3,符合条件的E的同分异构体有6种;(6)以有机物B为原料,结合题设合成路线和逆推法可知制备l,3一丁二醇的转化流程图为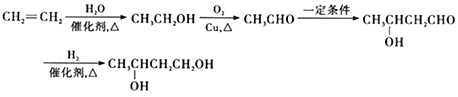 。
。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②某小组将NaOH固体置于称量纸上称量,并耽搁一段时间后再进行后续操作,则所得溶液浓度________(填“ >”、“<”或“=”)0.3 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm- 3的浓硫酸的体积为 ________ mL (计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为 ,它与水反应的离子方程式是 。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂_________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2 并测定其含量。取20.00 mL溶液,用稀H2SO4酸化,用0.002mol·L-1 KMnO4溶液滴定,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目: 2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O。
③溶液a中c(H2O2)=_________mol·L-1。
④溶液褪色速率后阶段变快的原因可能是____ _ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SO4溶液和KOH溶液反应时有热量放出,已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
(1)用离子方程式表示中和反应的实质 。
(2)判断E1和E2的大小关系:E1 E2。
(3)已知H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
①用20 g NaOH配成稀溶液与足量稀盐酸反应,能放出 kJ的热量。
②用0.1 mol Ba(OH)2配成稀溶液跟足量稀硝酸反应,能放出 kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤矿发生瓦斯爆炸往往与矿坑中的甲烷有关,下列叙述中错误的是
A.点燃甲烷不必事先进行验纯
B.甲烷燃烧放出大量的热,所以甲烷是一种很好的气体燃料
C.煤矿的矿井要注意通风并严禁烟火,以防爆炸事故的发生
D.点燃混有空气的甲烷不一定会爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com