
| A. | PCl5 | B. | SiH4 | C. | NF3 | D. | CO2 |
分析 对于共价化合物,元素化合价的绝对值+该元素原子核外电子数=8,该原子满足8电子结构.对应ABn分子,若中心原子最外层电子数=化合价的绝对值,分子为非极性分子,据此判断.
解答 解:A.PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,分子中P原子不满足8电子结构,P元素化合价=最外层电子数,为非极性分子,故A错误;
B.SiH4中Si元素化合价为+4,Si原子最外层电子数为4,所以4+4=8,分子中Si原子满足8电子结构,H原子一定不满足8电子结构,C元素化合价=最外层电子数,为非极性分子,故B错误;
C.NF3中N元素化合价为+3,N原子最外层电子数为5,所以3+5=8,分子中N原子满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以|-1|+7=8,分子中F原子满足8电子结构,N元素化合价≠最外层电子数,为极性分子,故C错误;
D.CO2中C元素的化合价为+4,C原子核外电子数为4,所以4+4=8,C原子满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,O原子满足8电子结构,C元素化合价=最外层电子数,为非极性分子,故D正确;
故选D.
点评 本题考查分子8电子结构判断与分子极性,难度不大,掌握判断规律是解题的关键,难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HF>HCl>HBr>HI | B. | 氧化性:I2>Br2>Cl2 | ||
| C. | 沸点:H2O>NH3 | D. | 还原性:HI>HBr>HCl>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3、NH4NO3 | B. | (NH4)2CO3、NH4NO3 | C. | NH4HCO3、NH4Cl | D. | NH4Cl、(NH4)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
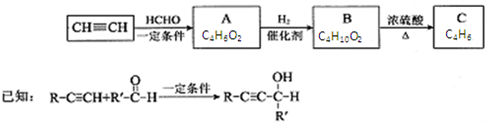
 ,其反应类型消去反应.
,其反应类型消去反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com