
| A、电解法精炼铜,用纯铜做阴极 |
| B、电解熔融的氧化铝制取金属铝,用铁做阳极 |
| C、电解饱和食盐水,用碳网做阴极 |
| D、在镀件上镀锌,用锌做阳极 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、石油的分馏和煤的气化都是发生了化学变化 |
| B、纤维素、油脂和蛋白质在一定条件下都能水解 |
| C、二氧化硅是半导体材料,可将太阳能直接转化为电能 |
| D、乙烯和苯都能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | Ka1:4.3×10-7 Ka2:5.6×10-11 |
| A、物质的量浓度相等的溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B、a mol?L-1 HCN与b mol?L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、向冰醋酸中逐滴加水至稀溶液过程中,溶液导电能力先增大,后减小 |
| D、将0.1 mol?L-1 的Na2CO3溶液逐滴加入到等浓度的HCN溶液中无明显现象,说明未反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.1g | B、3.6g |
| C、7.2g | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
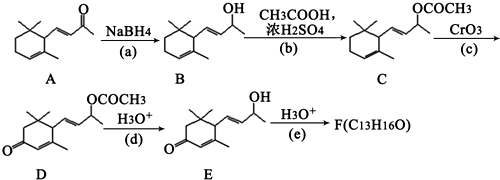
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑥⑦ | B、③④⑥⑦ |
| C、③④⑤⑥ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3?H2O的导电性比NaOH溶液弱得多 |
| B、0.1 mol?L-1NH3?H2O的pH大于7 |
| C、(NH4)2SO4的水溶液,其pH小于7 |
| D、5 mL1 mol?L-1的NH3?H2O跟10 mL0.5 mol?L-1的HCl恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合气体的平均组成为NO1.1 |
| B、原氨水的浓度约为17.3mol/L |
| C、吸收后氨水的浓度约为2.4mol/L |
| D、吸收后氨水的质量分数约为0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com