

·ÖĪö £Ø1£©øł¾Ż·śĄū°ŗÄܲśÉśĀČŌ×Ó£¬¶ųĀČŌ×ÓŹĒ³ōŃõ·Ö½āµÄ“߻ƼĮ£»
£Ø2£©¢ŁĢ¼ĖįĒā¼ŲŹÜČČ·Ö½ā£¬ĒŅĻąĶ¬Ģõ¼žĻĀĢ¼ĖįĒā¼ŲµÄČܽā¶Č±ČĢ¼Ėį¼ŲµÄŠ”£»
¢ŚÓÉĪüŹÕ³Ų”¢·Ö½ā³Ų·“Ó¦·ÖĪö£»
¢ŪŗĻ³ÉĖžÖŠ·¢Éś·“Ó¦ĪŖ¶žŃõ»ÆĢ¼ÓėĒāĘų·“Ӧɜ³É¼×“¼ŗĶĖ®£¬øł¾Ż4.4 kg CO2Óė×ćĮæH2Ē”ŗĆĶźČ«·“Ó¦£¬æɷųö4 947 kJµÄČČĮ棬Ōņ1 mol CO2ÓėĒāĘųŗĻ³É¼×“¼·Å³öČČĮæ49.47 kJµÄČČĮ森ŹéŠ“ČČ»Æѧ·“Ó¦·½³ĢŹ½Ź±»¹Ó¦×¢ŅāĪļ֏דĢ¬”¢·“Ó¦ČȵÄÕżøŗŗÅŅŌ¼°µ„Ī»£»
¢ÜÓÉCO2+4H2”śCH4+2H2OæÉÖŖ£¬CO2 ŗĶH2ŅŌ1£ŗ3µÄĢå»ż±Č»ģŗĶ£¬·¢ÉśCO2+3H2”śX+2H2O£®
½ā“š ½ā£ŗ£Ø1£©·śĄū°ŗŌŚæÕĘųÖŠÄܲśÉśĀČŌ×Ó£¬¶ųĀČŌ×ÓŹĒ³ōŃõ·Ö½āµÄ“߻ƼĮ£¬CO2×÷ÖĀĄä¼ĮæÉ·ĄÖ¹³ōŃõ²ćĘĘ»µ£¬¹Ź“š°øĪŖ£ŗ±£»¤³ōŃõ²ć£»
£Ø2£©¢Ł·Ö½ā³ŲÖŠĢ¼ĖįĒā¼ŲŹÜČČæÉ·Ö½ā³ÉĢ¼Ėį¼Ų”¢¶žŃõ»ÆĢ¼ŗĶĖ®£¬·½³ĢŹ½ĪŖ£ŗ2KHCO3$\frac{\underline{\;\;”÷\;\;}}{\;}$K2CO3+H2O+CO2”ü£¬ŌŚĪüŹÕ³ŲÖŠK2CO3+H2O+CO2ØT2KHCO3£¬ĪüŹÕ³ŲÖŠ±ä»ÆĖµĆ÷ĮĖKHCO3µÄČܽā¶Č±Č½ĻŠ”£¬Īö³ö¾§Ģ壬¹Ź“š°øĪŖ£ŗC£»
¢ŚÓÉĪüŹÕ³Ų”¢·Ö½ā³Ų·“Ó¦æÉÖŖĢ¼Ėį¼ŲŃ»·Ź¹ÓĆ£¬¹Ź“š°øĪŖ£ŗK2CO3£»
¢Ūøł¾Ż4.4 kg CO2Óė×ćĮæH2Ē”ŗĆĶźČ«·“Ó¦£¬æɷųö4 947 kJµÄČČĮ棬Ōņ1 mol CO2ÓėĒāĘųŗĻ³É¼×“¼·Å³öČČĮæ49.47 kJµÄČČĮ棬ĖłŅŌČČ»Æѧ·½³ĢŹ½ĪŖCO2£Øg£©+3H2£Øg£©ØTCH3OH£Øg£©+H2O£Øg£©”÷H=-49.47kJ/mol£¬¹Ź“š°øĪŖ£ŗCO2£Øg£©+3H2£Øg£©ØTCH3OH£Øg£©+H2O£Øg£©”÷H=-49.47kJ/mol£»
¢ÜÓÉCO2+4H2”śCH4+2H2OæÉÖŖ£¬CO2 ŗĶH2ŅŌ1£ŗ3µÄĢå»ż±Č»ģŗĶ£¬·¢Éś2CO2+6H2”śX+4H2O£¬ÓÉÖŹĮæŹŲŗć¶ØĀÉæÉÖŖXĪŖC2H4£¬ĪŖĻ©Ģž£¬¹Ź“š°øĪŖ£ŗB£®
µćĘĄ ±¾Ģāæ¼²é»ģŗĻĪļµÄ·ÖĄėĢį“æµÄ×ŪŗĻÓ¦ÓĆ£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĪļÖŹµÄŠŌÖŹ”¢Ļ°ĢāÖŠµÄŠÅĻ¢¼°Į÷³ĢÖŠµÄ·“Ó¦ĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £¬Ćū³ĘŹĒ»·¼ŗĶ飮
£¬Ćū³ĘŹĒ»·¼ŗĶ飮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
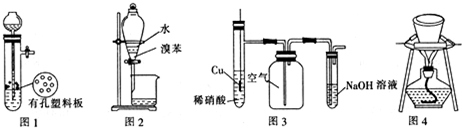
| A£® | Ķ¼1×°ÖĆÓĆÓŚCuŗĶÅØH2SO4·“Ó¦ÖĘȔɣĮæµÄSO2ĘųĢå | |
| B£® | Ķ¼2×°ÖĆÓĆÓŚ·ÖĄėĖ®ŗĶäå±½µÄ»ģŗĻĪļ | |
| C£® | Ķ¼3×°ÖĆÓĆÓŚÖʱø²¢ŹÕ¼ÆNOĘųĢå | |
| D£® | Ķ¼4×°ÖĆÓĆÓŚ³żČ„Ģ¼ĖįĒāÄĘ¹ĢĢåÖŠµÄÉŁĮæĢ¼ĖįÄĘ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹµŃéŹŅ³£ÓĆĀĮŃĪČÜŅŗÓėĒāŃõ»ÆÄĘČÜŅŗÖʱøAl£ØOH£©3³Įµķ | |
| B£® | ÅØĮņĖįÄÜøÉŌļSO2”¢NO2µČĘųĢ壬ĖµĆ÷ÅØĮņĖį¾ßÓŠĪüĖ®ŠŌ | |
| C£® | SO2 ¾ßÓŠĘư׊Ō£¬ĶØČė×ĻÉ«ŹÆČļČÜŅŗÖŠÄÜŹ¹ČÜŅŗĻȱäŗģŗóĶŹÉ« | |
| D£® | 30%µÄH2O2ČÜŅŗÖŠ¼ÓČėMnO2æÉÖʵĆO2£¬MnO2×öŃõ»Æ¼Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Č¼ÉÕŹ±ŹĒµĄ¶É«Ć÷ĮĮµÄ»šŃę | B£® | ÄÜŹ¹äåĖ®ĶŹÉ« | ||
| C£® | æÉÓėH2·¢Éś¼Ó³É·“Ó¦ | D£® | æÉÓėHCl¼Ó³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com