
��12�֣���Ȼˮ����������ˮ����Ҫ��Դ������Ȼˮ��ÿ������õ�ˮһ���뾭�����������ɱ�������Ȳ��衣
��1������������Ҫ��ˮ�м������������罫���μ���ˮ���ܴﵽ��ˮĿ�ģ�
ԭ���� �������ӷ���ʽ��ʾ����
��2����������������ˮɱ����������������ӷ���ʽ���������� ��
��3������ˮ������������� (K2FeO4)����ǿ���������ú��������á���ҵ�Ͽ�ͨ�����������Ʊ����������
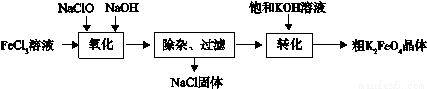
��������:�������������Ի�������Һ�л��ֽ⣬�ڼ�����Һ���ȶ���
��ɡ������������е����ӷ���ʽ
��Fe3+ + ��ClO- +�� =�� FeO42- + ��Cl- + ��
��ת����������ʵ����Na2FeO4�Ƶ�K2FeO4�������ö��� �ԵIJ�ͬ��
�����������ɴ�K2FeO4������ᴿ�����ֲ�Ʒ�� �ܽ⣬Ȼ���ټ��뱥��KOH��Һ����ȴ�ᾧ�����ˡ�
��������ص�Ӧ�û��ڲ�����չ�С�����Ƴɸ�����أ� ��ط�ӦΪ��
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
�ŵ�ʱ��������ӦΪ�� ��
��12�֣�
��1��Al3++3H2O Al(OH)3�����壩+ 3 H+ ��2�֣�
Al(OH)3�����壩+ 3 H+ ��2�֣�
��2�� Cl2 + H2O = HCl + HClO�����ɵ�HClO��ǿ�����ԣ�����ɱ���������á�
��2�֣�
��3���� 2Fe3+ + 3ClO- + 10 OH- = 2FeO42- + 3Cl- +5H2O ��2�֣�
�� �ܽ� ��2�֣�
�� ϡKOH��Һ�� ��2�֣�
�� 2FeO42-+6e-+8H2O==2Fe(OH)3+10OH- ��2�֣�
��������
�����������1�����μ���ˮ���ܴﵽ��ˮĿ�ģ�����Ϊ������ˮ��������������壬�����������ã����ӷ���ʽ��Al3++3H2O Al(OH)3�����壩+ 3 H+
Al(OH)3�����壩+ 3 H+
��2����������ˮ���ɴ����ᣬCl2 + H2O = HCl + HClO�����������ǿ�����ԣ�����ɱ��������
��3����������Ŀ������ͼ�жϷ�Ӧ�������������ƣ����Է�Ӧ��Ŀհ״�Ӧ��OH-�������Ŀհ״�Ӧ��H2O�����ݵ�ʧ�����غ㣬��ƽ�û�ѧ����ʽ������2Fe3+ + 3ClO- + 10 OH- = 2FeO42- + 3Cl- +5H2O ��
����ת����������ʵ����Na2FeO4�Ƶ�K2FeO4�������ö����ܽ��ԵIJ�ͬ��K2FeO4��Na2FeO4���ܽ��С��
���������������Ի�������Һ�л��ֽ⣬�ڼ�����Һ���ȶ������Խ��ֲ�Ʒ��ϡKOH��Һ�ܽ⣻
���ŵ�ʱ������ѧ��ת��Ϊ���ܣ�����������ԭ��Ӧ���缫����ʽΪ2FeO42-+6e-+8H2O==2Fe(OH)3+10OH-
���㣺�������ӵ�ˮ�⣬��������;����ѧ����ʽ����ƽ���绯ѧԭ����Ӧ��


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014�����д���������ͳһ��ϰ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾ��ʵ��װ�û���������ﵽʵ��Ŀ�ĵ���
|
| |
|
A������100 mL 0.1 mol /L���� | B�� ��֤AgCl��Ag2S���ܽ��� | C���ⶨ�кͷ�Ӧ �ķ�Ӧ�� | D��ʵ������ȡ ���ռ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�����з�̨��������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣���������Ȼ���еIJ���ѭ����ϵ���¡�
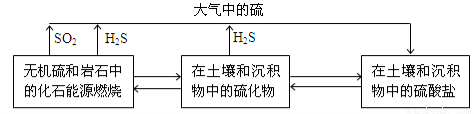
��1��H2S�ڿ����п���ȼ�ա�
��֪�� 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol ��
2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol ��
S(s) + O2(g)  SO2(g) ��H= ��297.04 kJ/mol ��
SO2(g) ��H= ��297.04 kJ/mol ��
H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ�� ��
��2��SO2�Ǵ�����Ⱦ���ˮ�������õ�����SO2����������������¡�
�� SO2���ں�ˮ����H2SO3��H2SO3���ջ�����SO32��������뷽��ʽ�� ��
�� SO32�����Ա���ˮ�е��ܽ�������ΪSO42������ˮ��pH�� ������ߡ� �������䡱���͡�����
�� Ϊ������ˮ��pH���ɼ������ʵĺ�ˮ��ʹ���е�HCO3�����뷴Ӧ���䷴Ӧ�����ӷ���ʽ�� ��
�� ��������Ӧ��ͬʱ��Ҫ���������������ԭ���� ��
��3����Ȼ��ر���ԭ��ͭ�����ᆳ�������������ú���CuSO4��Һ���������������������ܵ�ZnS������ת��Ϊͭ����CuS�����û�ѧ�����ʾ��ZnSת��ΪCuS�Ĺ��̣� ��
��4��SO2��O2��H2SO4��Һ�п��Թ���ԭ��أ��为����Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�����ж����������ڶ�ѧ���ۺ���ϰ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ���о�������ʴ��װ��ͼ������˵������ȷ����
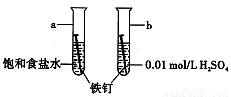
A��ab�������ĸ�ʴ���ʣ�a<b
B��a��b���������е�̼��Ϊ����
C��a��b���������е�����ʧ���ӱ�����
D��a��b������������Ӧʽ��ΪO2+4e-+ 4 H+=2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014���ɹų���и�����ѧ��4��ͳһ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���20mL0.2mol/LH2A��Һ�еμ�0.2mol/LNaOH��Һ���й��������ʵ����仯����ͼ������������H2A��������HA-��������A2-��������ͼͼʾ�жϣ�����˵���������ǣ� ��
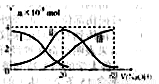
A����V��NaOH��=20mLʱ����Һ������Ũ�ȴ�С��ϵ��c(Na+)>c(HA����>c(H+)> c(A2��)>c(OH��)
B���������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ�Ĵ�
C��NaHA��Һ�У�c(OH-)��c(A2�C)��c(H+)��c(H2A)
D����Na2A��Һ����ˮ�Ĺ����У�pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1��2 | B��2��4 | C��3��6 | D��4��8 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com