
����Ŀ�����º��������£�����Է�������ת�����䷴Ӧ���̺�������ϵ��ͼ1��ʾ[��֪��2SO2(g)��O2(g)![]() 2SO3(g) ��H����196.6kJ��mol��1����ش��������⣺
2SO3(g) ��H����196.6kJ��mol��1����ش��������⣺
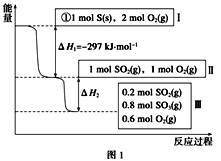
��1�����º���ʱ��1 mol SO2��2 mol O2��ַ�Ӧ���ų���������ֵ��|��H2|___(������������С�����������)��
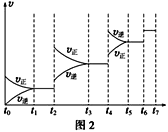
��2��ijSO2(g)��O2(g)��ϵ��ʱ��t1�ﵽƽ��ı�ijһ�����������Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ2��ʾ�������ı�SO2(g)��O2(g)��������ͼ��t4ʱ����ƽ���ƶ�������������___��ͼ�б�ʾƽ��������SO3�ĺ�����ߵ�һ��ʱ����____��
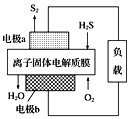
��3����ѧ����Ƴ�����ĤH2Sȼ�ϵ�أ�ʵ��������H2S������Դ�����������õ�����������ĤH2Sȼ�ϵ�صĽṹʾ��ͼ��ͼ��ʾ����缫b�Ϸ����ĵ缫��ӦΪ___����·��ÿͨ��4mol���ӣ��ڸ�������___L(���)���塣
���𰸡��� �����¶� t3-t4 O2+4H++4e=2H2O 44.8
��������
��1�����º���ʱ��1molSO2��2molO2 ����ʼ��1molSO2��1molO2 ��ȣ�������������Ũ�ȣ�ƽ�������ƶ�������SO2��ת���ʸߣ��ų���������ֵ��|��H2|��
��2��t2��t3���������ʶ��ӿ죬��v��������v���棩��ƽ�������ƶ���t4��t5���������ʶ��ӿ죬��v��������v���棩��ƽ�������ƶ����÷�ӦΪ�����С�ķ��ȷ�Ӧ���������¶ȣ�ƽ�������ƶ���������ѹǿ��ƽ�������ƶ�����t2��t3��Ϊ����ѹǿ��t4��t5��Ϊ�����¶ȣ�
t2��t3��Ϊ����ѹǿ��ƽ�������ƶ���SO3�ĺ������ߣ���t3��t4ƽ��ʱ��������ߣ�
��3������O2�õ��ӷ�����ԭ��Ӧ�����������£������õ�������ˮ����缫b�Ϸ����ĵ缫��ӦΪ��O2+4H++4e-=2H2O��������H2Sʧ���Ӳ���S2���缫��ӦʽΪ2H2S-4e-=S2+4H+�����ݷ�Ӧ��֪������·��ÿͨ��4mol���ӣ��ڸ�������22.4L/mol��2=44.8L(���)���塣


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ҫ�������Լ���ѡ���ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ��Ҫ���� | �Լ� | ʵ��Ŀ�� |
A | ��ƿ������©�����ƾ��ơ����� | ���̿���Ũ���� | ��ȡ���ռ���������� |
B | �ƾ��ơ������������������ż� |
| ������Һ�õ����� |
C | Բ����ƿ�������ܡ��ձ�������̨ | ����İ�����ˮ | ģ����Ȫʵ�� |
D | ��˿����ɫ�ܲ������ƾ��� | ���ᡢ����Һ | ��ɫ��Ӧʵ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100 ��ʱ����0.100 mol��N2O4�������1 L ��յ��ܱ������У��������·�Ӧ��N2O4![]() 2NO2����һ��ʱ��Ը������ڵ����ʽ��з������õ��±���
2NO2����һ��ʱ��Ը������ڵ����ʽ��з������õ��±���
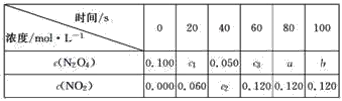
(1)�ﵽƽ��ʱ��N2O4��ת����Ϊ______________������c2________c3��a________b(����>������<����������)��
(2)20 sʱN2O4��Ũ��c1��________ mol��L��1����0��20 s��N2O4��ƽ����Ӧ����Ϊ________ mol��L��1��s��1��
(3)������ͬ���������������������Ƕ����������壬��Ҫ�ﵽ����ͬ����ƽ��״̬��������������ʼŨ����________ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ�Ȼ�ͭ��CuaClb(OH)c��xH2O���Ʊ���Ҫ��CuCl2����Fe3+�������õ������ԭ����ͼ��ʾ. �����й�˵����ȷ����

A.a��b��c ֮��Ĺ�ϵʽΪ��a=b+c
B.ͼ��M��N�ֱ�ΪFe2+��Fe3+
C.���Ʊ�1 mol��CuCl2������������11.2 LO2
D.N�μӵķ�Ӧ���ӷ���ʽΪ��4Fe2++ O2+ 4H+ = 4Fe3+ + 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��H2S �� Ka1 =1.0 ��10-7��Ka2 =1.0 ��10-15����˵����ȷ����
A.0.1 mol L-1�� NaHS��Һ�У�c(S2��)>c(H2S)
B.��Ӧ S2��+ H2O ![]() HS��+ OH�� ��ƽ�ⳣ�� K=1��10-7
HS��+ OH�� ��ƽ�ⳣ�� K=1��10-7
C.NaHS�� Na2S������Ȼ�ϵ���Һ�� ��c( Na+)+ c(H+)=c(HS��)+ c(S2��)+c(OH��)
D.0.1 mol L-1��Na2S ��Һ�У�c(OH��)= c(H+)+ c(HS��) + 2c(H2S)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
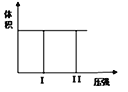
����Ŀ����I����һ���ݻ��̶�������ܱ������н��з�Ӧ��2X(g) + Y(g) ![]() 2Z(g)�� ����2molX��1molY���������ʱ������״̬I����Ӧ�ھ��������´ﵽƽ��ʱ����״̬II����ͼ������÷�Ӧ����H___0��(���<��>��=��)���÷�Ӧ��___������»���£����������Է����С�
2Z(g)�� ����2molX��1molY���������ʱ������״̬I����Ӧ�ھ��������´ﵽƽ��ʱ����״̬II����ͼ������÷�Ӧ����H___0��(���<��>��=��)���÷�Ӧ��___������»���£����������Է����С�
��II����֪2A2(g)+B2(g)![]() 2C(g) ��H=-akJ/mol(a��0)����һ���д����Ĺ̶��ݻ��������м���2molA2��1molB2����500��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊw mol/L���ų�����bkJ����ش��������⣺
2C(g) ��H=-akJ/mol(a��0)����һ���д����Ĺ̶��ݻ��������м���2molA2��1molB2����500��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊw mol/L���ų�����bkJ����ش��������⣺
��1��������Ӧ�¶����ߵ�700�棬��Ӧ��ƽ�ⳣ����___(����������������С������������)��
��2������ԭ���������У�ֻ����2molC��500��ʱ��ַ�Ӧ��ƽ�����������c kJ��a��b��c֮��������ֹ�ϵ(�ô���ʽ��ʾ)___��
��3����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬������_____��
a.V(C)=2V��B2�� b.����������ѹǿ���ֲ���
c.v��(A2)=2v����B2�� d.�����ڵ������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�������_____��
a.��ʱ�����C���� b.�ʵ������¶� c.����B2��Ũ�� d.ѡ���Ч�Ĵ���
��5����������������Ϊ��ѹ����(��Ӧǰ�����ͬ)����ʼʱ����2molA2��1molB2��500��ʱ��ַ�Ӧ��ƽ��ų�����dkJ����d___b(���=����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
��CO(g)��1/2O2(g)===CO2(g)����H����283.0 kJ��mol��1
��H2(g)��1/2O2(g)===H2O(g)����H����241.8 kJ��mol��1
����˵����ȷ����(����)
A. ͨ��״���£�������ȼ����Ϊ241.8 kJ��mol��1
B. �ɢٿ�֪��1 mol CO(g)��1/2 mol O2(g)��Ӧ���� 1 mol CO2(g)���ų�283.0 kJ������
C. ������ͼ��ʾ2CO2(g)===2CO(g)��O2(g)��Ӧ�����е������仯��ϵ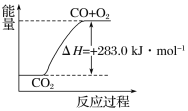
D. �ֽ�1 mol H2O(g)���䷴Ӧ��Ϊ��241.8 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M��W��X��Y��Z��ͬ��������Ԫ�أ�Xԭ�ӵ�������������Wԭ�Ӵ�����������3���������γɵĻ�������������͵�صĵ缫���ϣ��ṹ��ͼ��ʾ���������г�![]() ������ԭ�Ӿ�����8�����ȶ��ṹ������˵����ȷ����
������ԭ�Ӿ�����8�����ȶ��ṹ������˵����ȷ����
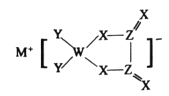
A.M�ĵ���ͨ��������ú����B.W������������Ӧ��ˮ������һԪ����
C.����̬�⻯���ȶ���X��YD.��������Ԫ����Z�ĵ縺�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧȡһ�������۽���ˮ��ʵ�飬��ʵ�鲽��������ʾ��
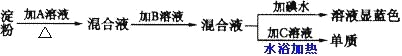
��ش��������⣺
�� ��������Լ��ֱ���
A_______��B________��C________��
�� ��B��ԭ����_____________________________________________________��
���ɴ˿�֪������________(����������������ȫ������û����)ˮ�⡣
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com