
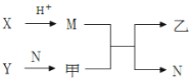
【题目】已知A、B、C、D为短周期内原子序数依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是
A. 沸点N>M
B. A、C、D的常见氧化物相互之间一定能反应
C. 简单离子半径:D2->B2->C+>A+
D. C与其他元素均能形成离子化合物
【答案】B
【解析】
甲、乙为其中两种元素对应的单质,Y与乙均为淡黄色固体,则乙为S,Y为Na2O2;X与Y、甲与乙摩尔质量相同,则甲为O2,X为Na2S;由转化关系图可知,M为H2S,N为H2O。
综上所述,A为H,B为O,C为Na,D为S,X为Na2S,Y为Na2O2,M为H2S,N为H2O。
A. N为H2O ,分子中存在着氢键,M为H2S所以沸点H2O >H2S,故A正确;B. A为H,C为Na,D为S,其常见氧化物A、C、D分别为H2O、H2O2、Na2O 、Na2O2、SO2、SO3,的相互之间H2O2和Na2O2不能反应,故B错误;C. 具有相同电子层结构的离子,核电荷数越小,半径越大,所以离子半径O2->Na+,又因为电子层数多,半径越大,所以S2->O2->Na+>H+,故C项正确;D. C为Na 为活泼金属溶易失电子,所以能与其他元素均能形成离子化合物,故D正确。答案:B。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和K[Al(OH)4]的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是

A. o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B. b—c段反应的离子方程式是:2[Al(OH)4]-+ CO2 = 2Al(OH)3↓ +CO32-+ H2O
C. a—b段与c—d段所发生的反应相同
D. d—e段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去)。

I.若A是能使湿润红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种常见无色无味的有毒气体,B、E均为汽车尾气成分。
(1)写出反应①的化学方程式____________。
(2)写出B和E在催化剂条件下生成C的化学方程式______________。
II.若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子;E为澄清石灰水。
(1)写出反应②的化学方程式_____________。
(2)将一定量的气体D通入2L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
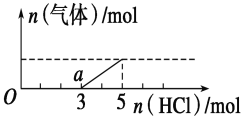
①O点溶液中所含溶质的化学式为_______,横坐标3-5段发生的离子方程式为_____。
②标况下,通入气体D的体积为______L,C溶液的物质的量浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
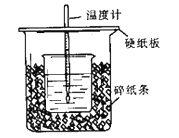
(1)观察实验装置,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是_________________________。
(3)大烧杯上口不盖硬纸板,测得的中和热数值 __________(填“偏大、偏小、无影响”)。
(4)实验中改用55mL 0.50 mol/L盐酸与55mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________ (填“相等、不相等”)。
(5)在中和热测定实验中,若用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热的数值会____(填“偏大”、“偏小”“不变”)原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )

A.用图1所示装置(正放)可收集NO气体
B.用图2所示装置可吸收多余氨气且能防止倒吸
C.用图3所示装置可实现反应:Cu+2H2O![]() Cu(OH)2+H2↑
Cu(OH)2+H2↑
D.用图4所示装置可分离乙醇(沸点78.4 ℃)与二甲醚(沸点24.9 ℃)的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.
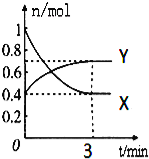
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. υ(C)=4 mol·(L·s)-1B. υ(B)=6 mol·(L·s)-1
C. υ(A)=3 mol·(L·s)-1D. υ(D)=2mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al ③Al(OH)3 ④MgO
A.②③B.①②③C.②③④D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com