
【题目】化学工业中Mn可用作氧化剂、助燃剂、活性电极材料、催化剂、油漆和油墨的干燥剂等,碳酸锰矿可作为制备MnO2原料
(1)已知25℃,101kPa时有如下的三个热化学方程式
①MnCO3(s) ![]() MnO(s)+CO2(g) △H1=+116 6kJ/mol
MnO(s)+CO2(g) △H1=+116 6kJ/mol
②2MnO(s)+O2(g) ![]() 2MnO2(s) △H2=-272.0kJ/mol
2MnO2(s) △H2=-272.0kJ/mol
③2MnCO3(s)+O2(g) ![]() 2Mn2(s)+2CO2(g) △H3
2Mn2(s)+2CO2(g) △H3
则△H3=_________;反应②在________条件下(填“高温”、“低温”或“任何温度”)能自发进行。
(2)在密闭容器中投入足量的 MnCO3,在一定条件下发生反应:MnCO3(s) ![]() Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
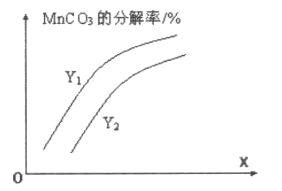
①温度、压强对碳酸锰平衡分解率的影响如图所示。图中Y1____Y2(填“>”、“<”或“=”)。
②保持温度不变,将体积扩大至原来的3倍,则容器内压强p(CO2)的变化范围为_______。
③若温度不变,将容器体积压缩至原来的一半,达到新平衡时,与原平衡状态相比,下列物理量一定不变的是________ (填字母)
A.CO2的质量 B. MnCO3的质量 C.MnCO3的分解率
D.化学平平衡常数 E.CO2的物质的量浓度
(3)在4L恒容密闭容器中,充入足量量的MnCO3(s)和a molO2(g),在一定温度下发生反应:MnCO3(s)+O2(g) ![]() 2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
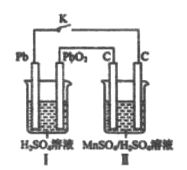
(4)现以铅蓄电池为电源,用石墨为电极,电解MnSO4和H2SO4混合液来制备MnO2,装置如图所示,阳极的电极反应式为___________,当蓄电池中有2mol H+被消耗时,则理理论上能生成MnO2________g
【答案】 -38.8kJ/mol 低温 < ![]() DE 10
DE 10 ![]() 43.5
43.5
【解析】(1) 根据盖斯定律,由①×2+②=③得ΔH3=2ΔH1+ΔH2=2×116-272=-38.8kJ/mol;反应②的正反应是气体分子数减小的反应,即熵减反应,ΔS<0,△H2<0,该反应在较低温度下能自发进行;正确答案:-38.8kJ/mol;低温。
(2)①从图像可知,减小压强,平衡右移,碳酸锰平衡分解率增大,因此Y1<Y2;正确答案:<。
②该反应的平衡常数为Kp=p(CO2);温度不变,平衡常数不变;假设减压(或扩大体积)时,平衡不移动,体积扩大至原来的3倍,则压强减小至原平衡的1/3,减压至p(CO2)=1/3 bMPa,即改变压强的瞬时,平衡已开始移动,压强的变化范围:![]() ;正确答案:
;正确答案:![]() 。
。
③MnCO3(s) ![]() Mno(s)+CO2(g) △H1=+116.6kJ/mol;若温度不变,将容器体积压缩至原来的一半,平衡左移,CO2的质量减小,A错误;MnCO3的质量增大,B错误;MnCO3的分解率减小,C错误;化学平衡常数只与温度有关,D错误;根据平衡常数为Kp=p(CO2),温度不变,平衡常数不变,CO2的物质的量浓度保持不变,E正确;正确选项DE。
Mno(s)+CO2(g) △H1=+116.6kJ/mol;若温度不变,将容器体积压缩至原来的一半,平衡左移,CO2的质量减小,A错误;MnCO3的质量增大,B错误;MnCO3的分解率减小,C错误;化学平衡常数只与温度有关,D错误;根据平衡常数为Kp=p(CO2),温度不变,平衡常数不变,CO2的物质的量浓度保持不变,E正确;正确选项DE。
(3)该段时间内CO2的化学反应速率为0.2molL-1·min-1,消耗CO2的浓度为1 molL-1;a molO2(g)的浓度为0.25a molL-1,
MnCO3(s)+O2(g) ![]() 2MnO2(s)+2CO2(g),
2MnO2(s)+2CO2(g),
起始量 0.25a 0
变化量 0.5 1
平衡量 0.25a-0.5 1
K=c2(CO2)/c(O2)= 0.5, 12/(0.25 a-0.5)= 0.5, a =10;正确答案:10。
4)铅蓄电池为电源,与二氧化铅相连的电极为阳极,溶液中锰离子失电子氧化为二氧化锰,极反应为![]() ;铅蓄电池总反应为Pb + PbO2 + 2H2SO4 == 2PbSO4↓ + 2H2O,转移电子2mol,有4molH+被消耗时,当有2mol H+被消耗时,转移电子1mol,根据
;铅蓄电池总反应为Pb + PbO2 + 2H2SO4 == 2PbSO4↓ + 2H2O,转移电子2mol,有4molH+被消耗时,当有2mol H+被消耗时,转移电子1mol,根据![]() 可知,生成MnO2的量为0.5 mol,质量为43.5 g;正确答案:
可知,生成MnO2的量为0.5 mol,质量为43.5 g;正确答案:![]() ;43.5。
;43.5。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】将1mL 0.1molL﹣1的H2SO4溶液加入纯水中制成200mL溶液,该溶液中由水自身电离产生的c(H+)最接近于( )
A.1×10﹣3 molL﹣1
B.1×10﹣13 molL﹣1
C.1×10﹣7 molL﹣1
D.1×10﹣11 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A. [NH4+]=[SO42-] B. [NH4+]>[SO42-]
C. [NH4+]<[SO42-] D. [OH-]+[SO42-]=[H+]+[NH4+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将22.4g铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是( )
A.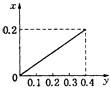
B.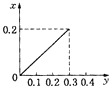
C.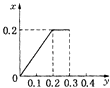
D.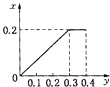
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2二溴乙烷的制备原理是:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
某课题小组用下图所示的装置制备1,2-二溴乙烷。

回答下列问题
(1)组装仪器后进行该实验前必须进行的操作是_________。
(2)装置B的作用是_______。
(3)三颈烧瓶内加入一定量的乙醇一浓硫酸混合液和少量粗砂,其加入粗砂目的是_______,仪器E的名称是_________________。
(4)装置C内发生的主要反应的离子方程式为__________________________。
(5)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A内反应温度升温至160-180℃,从滴液漏斗中慢慢滴加乙醇一浓硫酸混合液,保持乙烯气体均匀地通入装有3.20ml液溴(![]() 3g/cm3)和3ml水的D中试管,直至反应结束。
3g/cm3)和3ml水的D中试管,直至反应结束。
①将C与D连接处断开的原因是_____________________,
②判断反应结束的现象是______________________________。
(6)将粗品移入分液漏斗,分别用水、氢氧化钠溶液、水洗涤,产品用无水氯化钙干燥,过滤后蒸馏收集129-133℃馏分,得到7.896g1,2-二溴乙烷。1,2-二溴乙烷的产率为___________。
(7)下列操作中,不会导致产物产率降低的是________ (填正确答案的标号)
a.乙烯通入溴水时速率太快 b.装置E中的NaOH溶液用水代替.
c.去掉装置D烧杯中的水 d.实验时没有C装置 e. D中的试管里不加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应既属于氧化还原反应又属于吸热反应的是
A.铝片和稀盐酸反应B.氢氧化钡晶体和氯化铵反应
C.灼热的碳与CO2反应D.甲烷在氧气中燃烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是100mg CaC2O4H2O受热分解时,所得固体产物的质量随温度变化的曲线.试利用图中信息结合所学的知识,回答下列各问题: 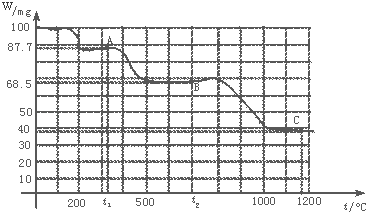
(1)温度分别为t1和t2时,固体产物的化学式A是 , B是 .
(2)由CaC2O4H2O得到A的化学方程式为 .
(3)由A得到B的化学方程式为 .
(4)由图计算产物C的相对分子质量,并推断C的合理的化学式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
A.NH3B.O2C.H2OD.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如图所示:

下列说法不正确的是( )
A. 该反应属于取代反应
B. 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
C. 用蒸馏的方法可将苯从反应所得产物中首先分离出来
D. 甲苯的沸点高于144℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com