
 现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题.
现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题. 如图,违背了泡利不相容原理.
如图,违背了泡利不相容原理.分析 A、B、C、D、E、F两种元素,它们的原子序数依次增大,其中前四种为短周期主族元素,后两种为第四周期元素.A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,则A为N元素;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子核外所有p轨道全满或半满,原子序数大于Mg,核外电子排布为1s22s22p63s23p3,故C为P元素;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F处于第四周期,且在第七列,则F为Mn,据此解答.
解答 解:A、B、C、D、E、F两种元素,它们的原子序数依次增大,其中前四种为短周期主族元素,后两种为第四周期元素.A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,则A为N元素;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子核外所有p轨道全满或半满,原子序数大于Mg,核外电子排布为1s22s22p63s23p3,故C为P元素;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F处于第四周期,且在第七列,则F为Mn.
(1)A为N元素,能量最高的电子为2p电子,其电子云在空间有3个方向,原子轨道呈哑铃形,
故答案为:3;哑铃;
(2)由泡利原理可知,电子在同一轨道内的自旋方向应相反,B基态原子的核外电子排布图中3s上的两个电子自旋方向相同,则违反了泡利不相容原理,
故答案为:泡利不相容;
(3)F处于第四周期,且在第七列,为ⅦB族元素,最后填充的为d电子,属于d区元素,核外电子数为25,有25种运动状态不同的电子,
故答案为:ⅦB;d;25;
(4)PCl3中P原子孤电子对数为1,成键数为3,则为sp3杂化,空间构型为三角锥形,E为K,检验K元素应利用焰色反应,
故答案为:sp3;三角锥形;焰色反应;
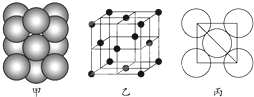
(5)由晶胞结构可知,以顶点原子研究,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为面心立方最密堆积,
晶胞的边长为 $\frac{\sqrt{2}}{2}$×4d cm=2$\sqrt{2}$d cm,所以晶胞的体积为(2$\sqrt{2}$d cm)3,根据均摊法可知,每个晶胞中含有的原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{M}{{N}_{A}}$g,所以晶胞的密度为4×$\frac{M}{{N}_{A}}$g÷(2$\sqrt{2}$d cm)3=
=$\frac{\sqrt{2}M}{8{d}^{3}{N}_{A}}$g•cm-3,
故答案为:12;面心立方最密堆积;$\frac{\sqrt{2}M}{8{d}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、元素周期表、杂化方式与空间构型、晶胞结构与计算等,注意识记中学常见的晶胞结构,掌握均摊法进行晶胞有关计算.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
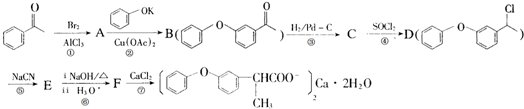
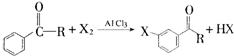
 的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个.
的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个. 、
、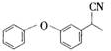 .
.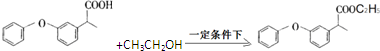 .
.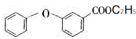 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) | |
| B. | 向1L 1mol/L 的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c (K+)+c (H+)=6c (ClO3-)+2c (ClO-)+c (HClO)+c (OH-) | |
| C. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| D. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
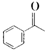
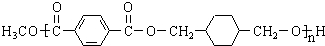 ,某研究小组用芳香烃A为原料合成PCT的合成路线如下.
,某研究小组用芳香烃A为原料合成PCT的合成路线如下.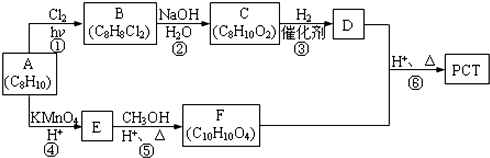
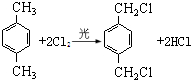 ,A分子中最多有14个原子共平面.
,A分子中最多有14个原子共平面.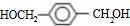 ,反应③的类型是加成反应,
,反应③的类型是加成反应,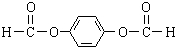 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 倭铅是指金属锌和铅的混合物 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的过程中有氧化还原反应发生 | |
| D. | 该冶炼锌的方法属于热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| B. | 34 g H2O2中含有的阴离子数为NA | |
| C. | 标准状况下,V L水含有的氧原子个数约为$\frac{V}{22.4}$NA | |
| D. | 1 mol Fe2+与足量的H2O2溶液反应,转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中加入明矾,可以起到杀菌消毒的作用 | |
| B. | 氧化铝中加入冰晶石,可以起到降低熔点的作用 | |
| C. | 药皂中加入少量苯酚,可以起到增白去污的作用 | |
| D. | 食品包装袋中放入生石灰,可以起到防止月饼等富脂食品氧化变质的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y两种元素形成的化合物中原子个数比一定为2:1 | |
| B. | Z、Y两种元素形成的化合物中只能含有离子键 | |
| C. | W元素形成的单质熔点很高,是一种优良的耐火材料 | |
| D. | Z、W、Q三种元素的最高价氧化物对应的水化物能两两反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com