
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
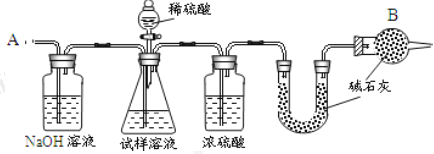
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明_________________。
(2)装置中干燥管 B 的作用是______________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是__________________________。
(5)步骤⑦的目的是__________________________。
(6)该试样中纯碱的质量分数的计算式为_______________________________。
【答案】 样品重,砝码轻 防止空气中的 CO2和水气进入 U 形管中 偏高 把反应产生的 CO2全部导入 U 形管中 判断反应产生的 CO2是否全部排出,并被 U 形管中的碱石灰吸收 ![]() ×100%
×100%
【解析】实验分析:本实验的目的为测定试样中Na2CO3的质量分数。实验原理为:w(Na2CO3)= 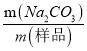 ×100%。先称取一定质量的样品,再将Na2CO3转化为CO2,利用碱石灰吸收CO2,通过称重得出CO2的质量,再间接的计算出Na2CO3的质量。为了精确测定CO2的质量,实验有两个关键点:保证CO2被全部吸收;防止其他气体的干扰。
×100%。先称取一定质量的样品,再将Na2CO3转化为CO2,利用碱石灰吸收CO2,通过称重得出CO2的质量,再间接的计算出Na2CO3的质量。为了精确测定CO2的质量,实验有两个关键点:保证CO2被全部吸收;防止其他气体的干扰。
(1)由于称量时左物右码,依据天平的杠杆原理,向左偏说明样品重,砝码轻。故答案为:样品重,砝码轻;
(2)U型管中的碱石灰是为了吸收反应生成的CO2,并通过称重得出CO2的质量,为了防止空气中的CO2和水蒸气进入影响实验结果,在U型管右侧接一个干燥管B,吸收空气中的CO2和水分。故答案为:防止空气中的CO2和水气进入U型管中;
(3)由于盐酸具有挥发性,也会随着CO2进入U型管,被碱石灰吸收,HCl被误认为是CO2,所以CO2的质量偏大,算出的Na2CO3的质量也会偏大的,所以结果会偏大。故答案为:偏高;
(4)由于反应完了锥形瓶中存留有CO2,鼓入一定量的空气就是将残留的CO2完全排入U型管。故答案为:把反应产生的CO2全部导入U型管中;
(5)直到U型管的质量基本不变,说明CO2已经被全部排到U型管中。故答案为:判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收;
(6)设需要碳酸钠的质量为x,则:
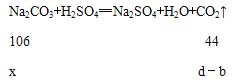
则有, ![]() ,解得x=
,解得x=![]() 。
。
所以试样中纯碱的质量分数的计算式为![]() ;故答案为:
;故答案为: ![]() ;
;


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】如果我们规定12C的相对原子质量为24,且0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),那么下列几种物理量不能发生变化的是: ①一个12C原子的质量 ②阿伏加德罗常数(NA)③摩尔质量④O2的相对分子质量⑤气体摩尔体积⑥![]() gC2H5OH的物质的量⑦98%(
gC2H5OH的物质的量⑦98%( ![]() )硫酸的物质的量浓度⑧44gCO2所含的分子个数
)硫酸的物质的量浓度⑧44gCO2所含的分子个数
A. ②③④ B. ①⑧ C. ①②⑦⑧ D. ①⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.石油液化气的主要成份为甲烷
B.煤的干馏可分离出煤中含有的煤焦油
C.石油的分馏和食盐水的蒸馏原理上是相似的
D.石油经过分馏得到的汽油是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是( )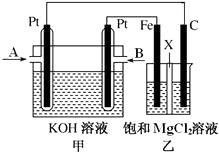
A.甲中A处通入CH4 , 电极反应式为CH4+10OH??8e? ![]()
![]() +7H2O
+7H2O
B.乙中电解MgCl2溶液的总反应为2Cl?+2H2O ![]() Cl2↑+H2↑+2OH?
Cl2↑+H2↑+2OH?
C.理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D.甲、乙中电解质溶液的pH都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的性质说法中不正确的是
A. 当光线照射胶体时可产生光亮的通路
B. 胶体具有吸附性,可以用作净水剂
C. 胶体区别于其它分散系的因素是胶体粒子的大小
D. 胶体是胶状物体,可以用肉眼也可以用光照鉴别出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com