
分析 (1)将①②相加,可得2H2O2=2H2O+O2↑,即亚铁离子在反应前后不变,则Fe2+起到催化剂的作用;
(2)根据反应(1)的特点,类比(1)书写反应的方程式;
(3)氧化还原反应中必须有电子得失,元素化合价升降;依据反应现象:放出大量的无色气体,溶液呈棕色.并可以使淀粉变蓝,可知反应生成氧气和碘,以此书写反应的方程式.
解答 解:(1)①2Fe2++H2O2+2H+=2Fe3++2H2O ②2Fe3++H2O2=2Fe2++O2↑+2H+将①②相加,可得2H2O2=2H2O+O2↑,即亚铁离子在反应前后不变,则Fe2+起到催化剂的作用,所以总反应为:2H2O2 $\frac{\underline{\;Fe_{2}+\;}}{\;}$2H2O+O2↑,
故答案为:催化剂;2H2O2 $\frac{\underline{\;Fe_{2}+\;}}{\;}$2H2O+O2↑;
(2)由(1)反应可知,H2O2+I2═2HIO,则另一反应应为HIO和H2O2反应生成碘和氧气,反应的化学方程式为2HIO+H2O2═I2+2H2O+O2↑,H2O2+I2═2HIO与2HIO+H2O2═I2+2H2O+O2↑相加得总方程式:2H2O2 $\frac{\underline{\;I_{2}\;}}{\;}$2H2O+O2↑;
故答案为:2HIO+H2O2═I2+2H2O+O2↑;2H2O2 $\frac{\underline{\;I_{2}\;}}{\;}$2H2O+O2↑;
(3)H2O2+2I-═I2+O2↑+2H+,该反应中只有化合价升高而没有化合价降低,不符合氧化还原反应的规律,所以不正确;通过反应的现象:放出大量的无色气体,溶液呈棕色.并可以使淀粉变蓝,可知反应生成氧气和碘,则反应的方程式为H2O2+2I-+2H+═2H2O+I2,2H2O2 $\frac{\underline{\;I_{2}\;}}{\;}$2H2O+O2↑,
故答案为:不正确;O元素和I元素的化合价均上升,没有化合价降低的元素;H2O2+2I-+2H+═2H2O+I2,2H2O2 $\frac{\underline{\;I_{2}\;}}{\;}$2H2O+O2↑.
点评 本题考查化学反应机理的探究,侧重于学生自学能力和探究能力的考查,题目难度中等,注意催化剂的催化原理和反应原理的探究.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在28g聚乙烯树脂中,含有的碳原子个数为2NA | |
| B. | 单体的质量之和不一定等于所生成的高聚物的质量 | |
| C. | 缩聚反应的单体至少有两种物质 | |
| D. | 我们通常所说的三大合成材料是指塑料、合成橡胶、合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  稀释浓硫酸 | B. |  比较MnO2、CI2、I2的氧化性 | ||
| C. |  分离乙醇和水 | D. |  比较Na2CO3、NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展氢能和太阳能 | B. | 限制塑料制品的使用 | ||
| C. | 提高原子利用率,发展绿色化学 | D. | 尽量用纯液态有机物代替水作溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 1mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
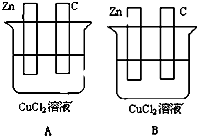 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2(s)+2Fe3+(aq)═2Fe(OH)3(s)+3Mg2+(aq) | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | 已知:酸的强弱H2CO3>HClO>HCO3-,则:2ClO-+CO2(少量)+H2O═CO32-+2HClO | |
| D. | 将足量的NaHCO3溶液加入少量澄清石灰水中:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com