
【题目】有机物H是合成免疫抑制剂药物霉酚酸的中间体,可由如下路径合成得到. 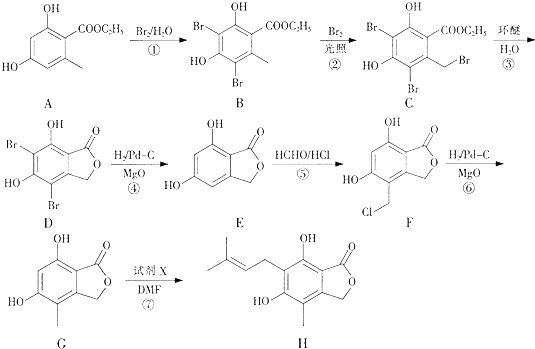
(1)有机物A中的含氧官能团的名称为 .
(2)由C转化为D的反应类型为 .
(3)反应⑦除了得到有机物H外还得到HBr,试剂X的结构简式为 .
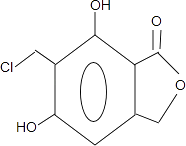
(4)步骤⑤可得到副产品有机物J,有机物J和有机物F互为同分异构体,写出有机物J的结构简式:(任写一种).
(5)E的一种同分异构体满足下列条件: Ⅰ.可以发生银镜反应,且能够与NaHCO3反应产生CO2;
Ⅱ.是芳香族化合物,且核磁共振氢谱图显示分子中有4种不同化学环境的氢.
写出该同分异构体的结构简式: .
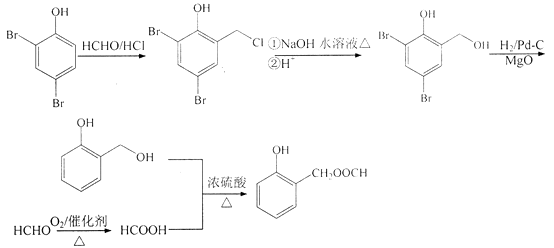
(6)已知:直接与苯环相连的卤素原子难以与NaOH水溶液发生取代反应.根据已有知识并结合相关信息,写出以 ![]() HCHO为原料制备
HCHO为原料制备 ![]() 合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH
合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH ![]() H2C=C2H
H2C=C2H ![]()
![]()
【答案】
(1)酚羟基、酯基
(2)取代反应
(3)(CH3)2C=CHCH2Br
(4)
(5)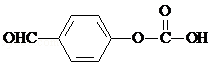 或
或 
(6)
【解析】解:(1)由A的结构简式可知,其含有的官能团有酚羟基、酯基,故答案为:酚羟基、酯基;(2)反应③是取代反应,生成酯基和CH2CH2Br,故答案为:取代反应;(3)反应⑦是在苯环的另一个空位上引入(CH3)2C=CHCH2CH2﹣,还得到HBr,说明是G与(CH3)2C=CHCH2Br发生取代反应,
故答案为:(CH3)2C=CHCH2Br;(4)反应⑤是在苯环上引入﹣CH2Cl,因为苯环上有两个空位,所以F可能存在同分异构体  ,
,
故答案为: 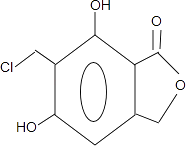 ;(5)E除苯环外还有4个氧原子2个碳原子,E的同分异构体可以发生银镜反应,说明含有醛基,能够与NaHCO3反应产生CO2,说明含有羧基,是芳香族化合物,且核磁共振氢谱图显示分子中有4种不同化学环境的氢,说明羧基和醛基在对位,E的同分异构体为
;(5)E除苯环外还有4个氧原子2个碳原子,E的同分异构体可以发生银镜反应,说明含有醛基,能够与NaHCO3反应产生CO2,说明含有羧基,是芳香族化合物,且核磁共振氢谱图显示分子中有4种不同化学环境的氢,说明羧基和醛基在对位,E的同分异构体为 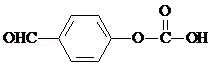 或
或  ,
,
故答案为: 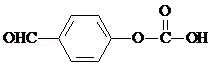 或
或  ;(6)以
;(6)以  、HCHO为原料制备
、HCHO为原料制备  ,需先在酚羟基的临位引入﹣CH2Cl,在水解生成﹣OH,去掉Br,醛基与甲酸酯化生成
,需先在酚羟基的临位引入﹣CH2Cl,在水解生成﹣OH,去掉Br,醛基与甲酸酯化生成  ,合成路线流程图为:
,合成路线流程图为: 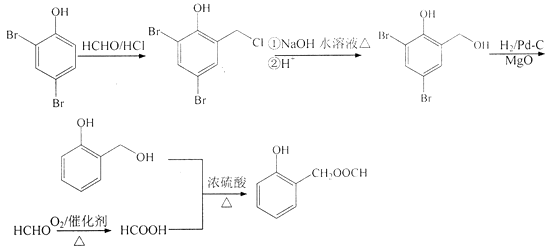
故答案为: 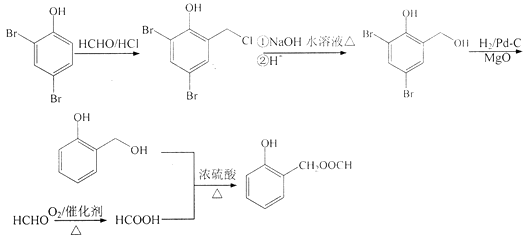 .
.
由合成H的路线图可知,反应①是酚羟基临位上的溴代反应,反应②是甲基上的卤代反应,反应③是取代反应,生成酯基,反应④是去掉苯环上的溴原子,反应⑤是在苯环上引入﹣CH2Cl,因为苯环上有两个空位,所以F可能存在同分异构体,反应⑥是使﹣CH2Cl生成﹣CH3的反应,反应⑦是在苯环的另一个空位上引入(CH3)2C=CHCH2﹣;以  、HCHO为原料制备
、HCHO为原料制备  ,需先在酚羟基的临位引入﹣CH2Cl,在水解生成﹣OH,去掉Br,醛基与甲酸酯化生成
,需先在酚羟基的临位引入﹣CH2Cl,在水解生成﹣OH,去掉Br,醛基与甲酸酯化生成  ,据此分析.
,据此分析.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(1)请写出金属钒与浓硝酸反应的离子方程式:__________________________________,
(2)灼烧NH4VO3时可生成钒的氧化物V2O5,请写出该反应的化学方程式:___________。
(3)V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:______________________________________。
(4)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:______、______。
(5)工业上用接触法制硫酸时要用到V2O5。在氧化SO2的过程中,450℃时发生V2O5与VO2之间的转化:V2O5+SO2=2VO2+SO3、4VO2+O2=2V2O5,说明V2O5在接触法制硫酸过程中所起的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
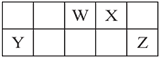
A. 氢化物沸点:W>Z B. 氧化物对应水化物的酸性:Y>W
C. WX2是酸性氧化物 D. 简单离子的半径: Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列们关说法正确的是
A. 石墨具有良好的润滑性,故可用做电池的电极材料。
B. 碳酸钠溶液呈碱性,故可用带玻璃塞的试剂瓶盛放
C. 液氮的沸点较低,故可为超导材料提供低温环境
D. 单晶硅的硬度较高,故可用于制备电子芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关稀溶液中离子浓度的说法正确的是( )
A.同浓度的四种溶液:①NH4Cl ②(NH4)2SO4③NH4HSO4④NH4Al(SO4)2溶液,c(NH4+)浓度的大小关系:②>④>③>①
B.一定浓度的NaHS溶液中:c(Na+)+c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
C.若0.1 mol/L NH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1﹣10﹣5)mol/L
D.现有四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水电离出的氢离子浓度大小关系为:②=④>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒。某兴趣小组进行下面实验探究,查阅资料知道:
①HNO2为弱酸 ;
②2NO+Na2O2=2NaNO2 ;
③2NO2+Na2O2=2NaNO3 ;
④酸性KMnO4溶液可将NO和NO2-均氧化为NO3-,MnO4-还原成Mn2+ 。NaNO2的制备方法可有如下2种方法(夹持装置和加热装置已略,气密性已检验):
(1)在制备装置1中:
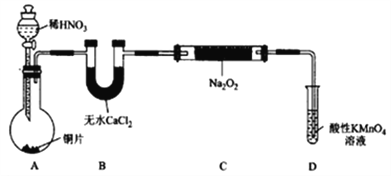
① 如果没有B装置,C中发生的副反应有_________,_________;
② 甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质;于是在A装置与B装置间增加了 ____________装置,改进后提高了NaNO2的纯度;
③ D装置发生反应的离子方程式为 ____________________。
(2)在制备装置2中:
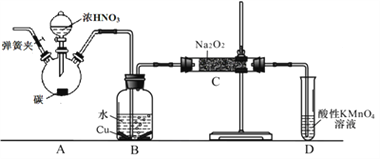
① B装置的作用是 _________________________;
② 写出装置A烧瓶中发生反应的化学方程式并用单线桥标出电子的转移 _____;
③ 为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为 ________;
④根据题中所给信息,设计实验检验装置C中NaNO2的存在时,应使用_________。(填试剂名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.短周期元素形成离子后,最外层都达到8电子稳定结构
B.第二周期元素的最高正化合价等于它所处的主族序数
C.同一元素可能既表现金属性,又表现非金属性
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. 该装置为电解装置,B为阳极
B. 电子是从A极沿导线经小灯泡流向B极
C. A极的电极反应式为![]()
D. 当外电路中有0.1mole-转移时,A极区增加的H+的个数为0.05NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com