
以下最接近阿伏伽德罗常数的是()
A. 2.0L 1.Omol•L﹣1 CH3COOH溶液中的H+离子数
B. 2.0L 1.0 mol•L﹣1CH3COONa溶液中的CH3COO﹣离子数
C. 1.0L 1.0 mol•L﹣1NaHCO3溶液中的HCO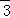 离子数
离子数
D. 1.0L 1.0 mol•L﹣1Na2CO3 溶液中的 C032﹣离子数
考点: 阿伏加德罗常数.
分析: A、醋酸是弱电解质存在电离平衡,溶质物质的量为2mol;
B、醋酸根离子水解减小,溶质物质的量为2mol;
C、碳酸氢根离子水解,溶质物质的量为1mol;
D、碳酸根离子水解,溶质物质的量为1mol;
解答: 解:A、醋酸是弱电解质存在电离平衡,溶质物质的量为2mol,溶液中的氢离子数接近2mol,故A不符合;
B、醋酸根离子水解减小,溶质物质的量为2mol,溶液中醋酸根离子物质的量接近2mol,故B不符合;
C、碳酸氢根离子水解,溶质物质的量为1mol,水解程度小于碳酸根,故C符合;
D、碳酸根离子水解,溶质物质的量为1mol,碳酸根离子水解程度大于碳酸氢根,故D不符合;
故选C.
点评: 本题考查了盐类水解的程度分析和实质理解,阿伏伽德罗常数概念的应用,题目难中等


科目:高中化学 来源: 题型:
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是()
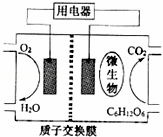
A. 该电池能够在高温下工作
B. 电池的负极反应为:C6H12O6+6H2O﹣24e﹣=6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体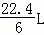
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾在不同的条件下发生的反应如下:
MnO4﹣+5e﹣+8H+═Mn2++4H2O①
MnO4﹣+3e﹣+2H2O═MnO2↓+4OH﹣②
MnO4﹣+e﹣═MnO42﹣(溶液绿色)③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的酸碱性影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 ﹣→ +.
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质):
KMnO4+ K2S+ KOH═ K2MnO4+3K2SO4+2S↓+ .
②若生成6.4g单质硫,反应过程中转移电子的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于加成反应的是()
A. CH2=CH2+HBr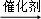 CH3CH2Br
CH3CH2Br
B. 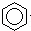 +Br2
+Br2
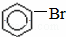 +HBr
+HBr
C. 2CH3CH2OH+O2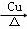 2CH3CHO+2H2O
2CH3CHO+2H2O
D. CH4+2Cl2 CH2Cl2+2HCl
CH2Cl2+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
(1)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol
③H2O(g)=H2O(1)△H3=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a.则Tl T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为 .
②100℃时,将1mol CH4和2mol H2O通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是 .
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4同时生成0.3mol H2
c.容器的压强恒定
d.3v正(CH4)=v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K=2.25.
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为
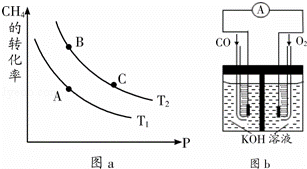
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置不能达到实验目的是()
A. 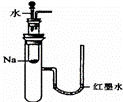
验证Na和水反应是否为放热反应
B. 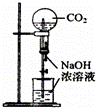
用CO2做喷泉实验
C. 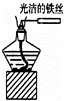
观察纯碱的焰色反应
D. 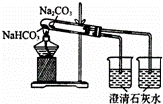
比较Na2CO3、NaHCO3的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
配制100mL 1.0mol/LNa2CO3溶液,下列操作正确的是()
A. 称取10.6g无水碳酸钠,加入100mL容量瓶中,加水溶解、定容
B. 称取10.6g无水碳酸钠,加入100mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高或最低化合价 +2 +1 +5 +7 +1 +5 +3
﹣2 ﹣3 ﹣1 ﹣3
下列说法正确的是()
A. 原子序数④元素大于⑦元素
B. ②、③处于同一周期
C. 上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
D. ⑧号元素原子结构示意图为:
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法中正确的是( )
|
| A. | 1NA个氢气分子所占的体积为22.4L |
|
| B. | 2NA个二氧化碳分子的质量为44g |
|
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+与Cl﹣离子总数为0.2NA |
|
| D. | 17g氨气中所含原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com