
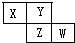
 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | Z元素的氧化物对应的水化物是强酸 | |
| B. | 含有X、Y、Z的化合物一定是共价化合物 | |
| C. | X的气态氢化物与W的气态氢化物反应的生成物中一定含有离子 | |
| D. | 原子半径大小顺序:X>Y>Z>W |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,Y原子只能有2个电子层,次外层电子数为2,最外层电子数为6,则Y为O元素,由图中的位置可知,X为N,Z为S,W为Cl,然后利用元素周期律及物质的性质来解答.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,Y原子只能有2个电子层,次外层电子数为2,最外层电子数为6,则Y为O元素,由图中的位置可知,X为N,Z为S,W为Cl,
A.Z为S元素,三氧化硫对应的水化物为硫酸,属于强酸,但二氧化硫对应的水化物是亚硫酸,属于弱酸,故A错误;
B.硫酸铵中含X、Y、Z,为离子化合物,故B错误;
C.X的氢化物是氨气,W是氢化物是氯化氢,氨气和氯化氢反应生成氯化铵,氯化铵由离子构成,故C正确;
D.同周期从左向右原子半径在减小,电子层越多原子半径越大,则原子半径:Z>W>X>Y,故D错误;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意Y为推断元素的突破口,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Cl?、HCO3? | B. | Na+、NO3-、SO42-、I? | ||
| C. | Na+、Mg2+、Cl?、SO42- | D. | Fe3+、K+、Cl?、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
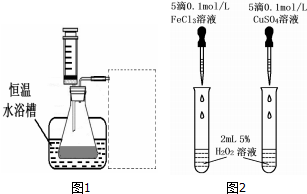
| 所需试剂 | 操作及现象 | 结论 |
| Cl对H2O2分解无催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了保护环境,节约资源,不使用一次性筷子、纸杯、塑料袋等 | |
| B. | 为了提高肥效、收割小麦、玉米等作物后将秸秆及时焚烧 | |
| C. | 为了提高农作物的产量和质量,应大量使用化肥和农药 | |
| D. | 为了防止干电池造成环境污染,应将废旧电池深埋处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +5,-3 | -2 |
| A. | GOH溶液和M(OH)3可以相互反应 | B. | 非金属性:T<Q | ||
| C. | 气态氢化物的稳定性:R>T | D. | L2+与T2-核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高化合价依次升高 | |
| C. | N、O、F原子半径依次增大 | |
| D. | P、S、Cl元素的最低化合价依次为-3、-2、-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NF3中N的价态为-3价 | |
| B. | 该反应中NH3为还原剂,还原产物只有NF3 | |
| C. | 若有4 mol的氨气反应,转移的电子数目为6 NA | |
| D. | F2的摩尔质量为38 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com