
”¾ĢāÄæ”æŅ©Īļ°¢×ōĪō·ŅFÖ÷ŅŖÓĆÓŚ·ĄÖĪ¹ĒÖŹŹčĖÉÖ¢µČ”£ĘäŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
Ēė°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
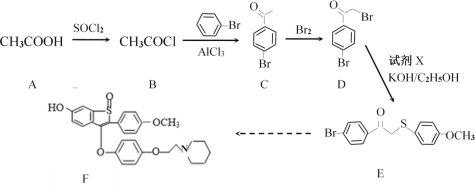
£Ø1£©AÖŠ×ī¶ą¹²Ę½ĆęµÄŌ×ÓŹżÄæ£ŗ______£»CÖŠĖłŗ¬¹ŁÄÜĶÅĆū³Ę£ŗ_______£»C”śDµÄ·“Ó¦ĄąŠĶ______________”£
£Ø2£©ŅŃÖŖĀ±Ō×ÓÖ±½ÓÓė±½»·ĻąĮ¬Ź±Ģ¼Ā±¼ü·Ē³£ĄĪ¹Ģ£¬ŗÜÄѶĻ¼ü”£Š“³öDÓėNaOHĖ®ČÜŅŗ¼ÓČČĢõ¼žĻĀ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ________________________________________”£
£Ø3£©ŹŌ¼ĮXµÄ·Ö×ÓŹ½ĪŖC7H8OS£¬Š“³öXµÄ½į¹¹¼ņŹ½£ŗ___________________”£
£Ø4£©CµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåMĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄĖłÓŠæÉÄܵĽį¹¹ÓŠ£Øæ¼ĀĒĖ³·“Ņģ¹¹ĻÖĻó£©_________ÖÖ”£
a.±½»·ÉĻÓŠĮ½øöČ”“ś»ł
b.ÄÜÓėFeCl3ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦
c.ÄÜŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗĶŹÉ«
Š“³öĘäÖŠÓŠ4ÖÖ²»Ķ¬»Æѧ»·¾³ĒāŌ×ӵĽį¹¹¼ņŹ½£ŗ_______________________”£
£Ø5£©ĒėŠ“³öŅŌ1-±ū“¼ŗĶĀȱ½ĪŖŌĮĻ¾ĖIJ½Öʱø ![]() µÄŗĻ³ÉĀ·ĻߣØĘäĖūŹŌ¼ĮČĪŃ”£¬ŗĻ³ÉĀ·Ļߏ¾Ąż¼ūĢāøÉ£¬ÓŠ»śĪļ¾łŠ“½į¹¹¼ņŹ½£©”£________”£
µÄŗĻ³ÉĀ·ĻߣØĘäĖūŹŌ¼ĮČĪŃ”£¬ŗĻ³ÉĀ·Ļߏ¾Ąż¼ūĢāøÉ£¬ÓŠ»śĪļ¾łŠ“½į¹¹¼ņŹ½£©”£________”£
”¾“š°ø”æ6 äåŌ×Ó”¢ōŹ»ł Č”“ś·“Ó¦  +NaOH
+NaOH![]()
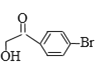 +NaBr
+NaBr ![]() 9
9 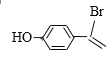
![]()
”¾½āĪö”æ
£Ø1£©AĪŖ“×Ėį£¬ĘäÖŠōČ»łÖŠ4øöŌ×Ó¹²Ę½Ćę£¬¼×»łÖŠ×ī¶ąÓŠ2øöŌ×ÓÓėōČ»ł¹²Ę½Ćę£¬¹Ź·Ö×ÓÖŠ×ī¶ąÓŠ6øöŌ×Ó¹²Ę½Ćę£»CÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅĪŖōŹ»ł”¢äåŌ×Ó£»C”śDµÄ·“Ó¦ĄąŠĶĪŖČ”“ś·“Ó¦£»
£Ø2£©øł¾ŻŅŃÖŖĢõ¼ž£¬NaOHÖ»ÄÜŗĶ±½»·²ąĮ“ÉĻµÄäåŌ×Ó·¢Éś·“Ó¦£¬¹Ź·“Ó¦·½³ĢŹ½ĪŖ +NaOH
+NaOH![]()
 +NaBr£»
+NaBr£»
£Ø3£©øł¾ŻEµÄ·Ö×ÓŹ½ŗĶD”śEµÄ·“Ó¦æÉŅŌĶʶĻ³ö£¬ŹŌ¼ĮXµÄ½į¹¹¼ņŹ½ĪŖ![]() £»
£»
£Ø4£©øł¾ŻĢõ¼ž£¬bĖµĆ÷ĪļÖŹ½į¹¹ÖŠ“ęŌŚ·ÓōĒ»ł£¬cĖµĆ÷“ęŌŚĖ«¼ü£¬ÓÖŠčĀś×ćÓŠ4ÖÖ²»Ķ¬»Æѧ»·¾³ĒāŌ×Ó£¬¹Ź“š°øĪŖ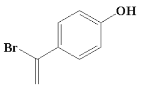 £»
£»
£Ø5£©øł¾ŻĢāÄæĖłøųŠÅĻ¢£¬æɽ«±ū“¼“ß»ÆŃõ»Æ±ä³É±ūČ©£¬½«±ūČ©Ńõ»Æ±ä³É±ūĖį£¬½«±ūĖįŗĶŃĒĮņõ£ĀČ·“Ӧɜ³ÉCH3CH2COCl£¬×īŗóŗĶĀȱ½·¢Éś·“Ó¦¼“µĆµ½Äæ±ź²śĪļ£¬ŗĻ³É¹ż³ĢĪŖ![]() ”£
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚŹµŃé²Ł×÷µÄŠšŹöÖŠÕżČ·µÄŹĒ( )
¢Ł“ÓŹŌ¼ĮĘæÖŠČ”³öµÄČĪŗĪŅ©Ę·,ČōÓŠŹ£Óą²»ÄÜŌŁ·Å»ŲŌŹŌ¼ĮĘæ ¢ŚæÉČ¼ŠŌĘųĢåµćČ¼Ö®Ē°±ŲŠėŃé“æ
¢ŪÓĆ½ŗĶ·µĪ¹ÜĻņŹŌ¹ÜÖŠµĪ¼ÓŅŗĢå,Ņ»¶ØŅŖ½«½ŗĶ·µĪ¹ÜÉģČėŹŌ¹ÜÖŠ
¢ÜÓĆĶŠÅĢĢģĘ½³ĘĮæ¹ĢĢåŅ©Ę·Ź±,Ó¦×óĪļÓŅĀė
¢ŻÅäÖĘÅØĮņĖįÓėÕōĮóĖ®µÄ»ģŗĻŅŗŹ±,Ó¦½«ÅØĮņĖįĀżĀż¼Óµ½ÕōĮóĖ®ÖŠ²¢¼°Ź±Ąæ°čŗĶĄäČ“
¢ŽŃ”ÓĆ![]() ĮæĶ²ĮæČ”
ĮæĶ²ĮæČ”![]() Ļ”ĮņĖį
Ļ”ĮņĖį
A.¢Ł¢Ū¢Ü¢ŻB.¢Ł¢Ū¢Ü¢Ž
C.¢Ś¢Ü¢ŻD.ŅŌÉĻ“š°ø¾ł²»ÕżČ·
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ÓĆ0.1mol/LKOHČÜŅŗµĪ¶Ø10mL0.1mol/LHAČÜŅŗµÄµĪ¶ØĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
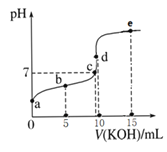
A.aµćpHŌ¼ĪŖ3£¬æÉŅŌÅŠ¶ĻHAŹĒČõĖį
B.bµćČÜŅŗ£ŗc(A-)£¾c(K+)£¾c(HA)£¾c(H+)£¾c(OH-)
C.cµćČÜŅŗ£ŗc(K+)=c(A-)
D.Ė®µÄµēĄė³Ģ¶Č£ŗcµć£¾dµć
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧæĪĶāŠ”×éÉč¼ĘĮĖČēĶ¼ĖłŹ¾µÄ×°ÖĆÖĘČ”ŅŅĖįŅŅõ„£ØĶ¼ÖŠ¼Š³ÖŅĒĘ÷ŗĶ¼ÓČČ×°ÖĆŅŃĀŌČ„£©”£ŅŃÖŖĻĀĮŠŹż¾Ż£ŗ
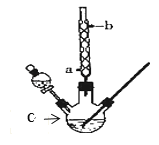
ŅŅ“¼ | ŅŅĖį | ŅŅĖįŅŅõ„ | 98%ÅØĮņĖį | |
ČŪµć/”ę | ©117.3 | 16.6 | ©83.6 | |
·Šµć/”ę | 78.5 | 117.9 | 77.5 | 338.0 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŅĒĘ÷CµÄĆū³ĘĪŖ______£¬ĒņŠĪĄäÄż¹ÜµÄ×÷ÓĆŹĒ_____”£
(2)ĻņCÖŠ¼ÓČė·“Ó¦Īļ£¬“ż³ä·Ö·“Ó¦ŗ󣬽«CÖŠµÄ»ģŗĻĪļµ¹Čė×°ÓŠ±„ŗĶĢ¼ĖįÄĘČÜŅŗµÄÉÕ±ÖŠ³ä·ÖÕńµ“Ļ“µÓ”£±„ŗĶĢ¼ĖįÄĘČÜŅŗ×÷ÓĆŹĒ£ØĢī×ÖÄø£©£ŗ_____
A.ÖŠŗĶŅŅĖį²¢ČܽāŅŅ“¼
B.Ģ¼ĖįÄĘČÜŅŗ³Ź¼īŠŌ£¬ÓŠĄūÓŚŅŅĖįŅŅõ„µÄĖ®½ā
C.¼ÓĖŁŅŅĖįŅŅõ„µÄÉś³É£¬ĢįøßĘä²śĀŹ
D.ŅŅĖįŅŅõ„ŌŚ±„ŗĶĢ¼ĖįÄĘČÜŅŗÖŠµÄČܽā¶Č±ČŌŚĖ®ÖŠøüŠ”£¬ÓŠĄūÓŚ·Ö²ćĪö³ö
(3)¾¶ą“ĪÕńµ“Ļ“µÓ”¢¾²ÖĆ·ÖŅŗŗó£¬ĪŖĮĖ½ųŅ»²½Ģį“æŅŅĖįŅŅõ„£¬æɲÉÓĆÕōĮóµÄ·½·Ø£¬ÕōĮóŹ±æŲÖĘĪĀ¶ČŌŚ__×óÓŅ£¬ĪĀ¶Č¼ĘµÄĖ®ŅųĒņÓ¦Ī»ÓŚ____”£
(4)ČōŹµŃéĖłÓĆŅŅĖįÖŹĮæĪŖ2.4g£¬ŅŅ“¼ÖŹĮæĪŖ2.1g£¬µĆµ½“æ¾»µÄ²śĘ·ÖŹĮæĪŖ2.64g£¬ŌņŅŅĖįŅŅõ„µÄ²śĀŹŹĒ______”£
(5)ŅŅĖįŅŅõ„ÓėĒāŃõ»ÆÄĘČÜŅŗ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ»īŠŌŃõæÉŅŌ°ŃSO2æģĖŁŃõ»ÆĪŖSO3£¬øł¾Ż¼ĘĖć»śÄ£Äā½į¹ū£¬ŌŚĢæŗŚ±ķĆęÉĻO2×Ŗ»ÆĪŖ»ī»ÆŃõµÄ·“Ó¦Ąś³ĢÓėÄÜĮæ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
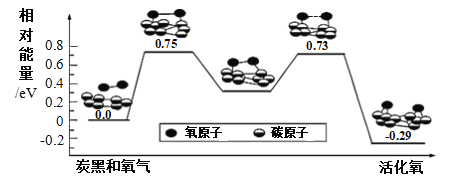
A.O2×Ŗ»ÆĪŖ»ī»ÆŃõÓėĢ¼Ńõ¼üÉś³ÉĪŽ¹Ų
B.Ćæ»ī»Æ1øöO2·Ö×Ó×īÖÕĪüŹÕ0.29 eVÄÜĮæ
C.øĆ¹ż³ĢµÄ×ī“óÄÜĄŻ£Ø»ī»ÆÄÜ£©EÕż= 0.73 eV
D.ĢæŗŚæɼÓæģSO2×Ŗ»ÆĪŖSO3µÄ·“Ó¦ĖŁĀŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ2019ÄźĪŖ”°¹ś¼Ź»ÆѧŌŖĖŲÖÜĘŚ±ķÄź”±”£ČēĶ¼ĖłŹ¾ŹĒŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö£¬W”¢X”¢Y”¢ZĪŖ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£¬WÓėXµÄ×īøß»ÆŗĻ¼ŪÖ®ŗĶĪŖ8”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
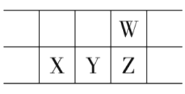
A.Ō×Ó°ė¾¶£ŗW<X
B.ĘųĢ¬Ēā»ÆĪļČČĪČ¶ØŠŌ£ŗZ<W
C.Yµ„ÖŹæÉÓĆ×ö°ėµ¼Ģå²ÄĮĻ
D.XµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļŹĒĒæ¼ī
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉé(As)ŹĒŅ»Š©¹¤³§ŗĶæóɽ·ĻĖ®ÖŠµÄĪŪČ¾ŌŖĖŲ,Ź¹ÓĆĪüø½¼ĮŹĒČ„³żĖ®ÖŠÉéµÄÓŠŠ§“ėŹ©Ö®Ņ»”£
£Ø1£©½«ĮņĖįĆĢ”¢ĻõĖįīĘÓėĒāŃõ»ÆÄĘČÜŅŗ°“Ņ»¶Ø±ČĄż»ģŗĻ£¬½Į°čŹ¹Ęä³ä·Ö·“Ó¦£¬æÉ»ńµĆŅ»ÖÖÉéµÄøߊ§Īüø½¼ĮX£¬Īüø½¼ĮXÖŠŗ¬ÓŠ![]() £¬ĘäŌŅņŹĒ_______________________________”£
£¬ĘäŌŅņŹĒ_______________________________”£
£Ø2£©H3AsO3ŗĶH3AsO4Ė®ČÜŅŗÖŠŗ¬ÉéµÄø÷ĪļÖֵķֲ¼·ÖŹż(Ę½ŗāŹ±Ä³ĪļÖÖµÄÅضČÕ¼ø÷ĪļÖÖÅضČÖ®ŗĶµÄ·ÖŹż)ÓėpHµÄ¹ŲĻµ·Ö±šČēĢā20Ķ¼- 1ŗĶĢā20Ķ¼- 2ĖłŹ¾”£

¢ŁŅŌ·ÓĢŖĪŖÖøŹ¾¼Į(±äÉ«·¶Ī§pH 8.0 ~ 10.0)£¬½«NaOHČÜŅŗÖšµĪ¼ÓČėµ½H3AsO3ČÜŅŗÖŠ£¬µ±ČÜŅŗÓÉĪŽÉ«±äĪŖĒ³ŗģÉ«Ź±Ķ£Ö¹µĪ¼Ó”£øĆ¹ż³ĢÖŠÖ÷ŅŖ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________”£
¢ŚH3AsO4µŚŅ»²½µēĄė·½³ĢŹ½H3AsO4![]() H2AsO4-+H+µÄµēĄė³£ŹżĪŖKa1,ŌņpKa1=______(p Ka1 = -lg Ka1 )”£
H2AsO4-+H+µÄµēĄė³£ŹżĪŖKa1,ŌņpKa1=______(p Ka1 = -lg Ka1 )”£
£Ø3£©ČÜŅŗµÄpH¶ŌĪüø½¼ĮX±ķĆęĖł“ųµēŗÉÓŠÓ°Ļģ”£pH =7£®1Ź±, Īüø½¼ĮX±ķĆę²»“ųµēŗÉ; pH > 7.1Ź±“ųøŗµēŗÉ,pHŌ½øß,±ķĆęĖł“ųøŗµēŗÉŌ½¶ą;pH<7.1Ź±“ųÕżµēŗÉ,pHŌ½µĶ,±ķĆęĖł“ųÕżµēŗÉŌ½¶ą”£pH²»Ķ¬Ź±Īüø½¼ĮX¶ŌČż¼ŪÉéŗĶĪå¼ŪÉéµÄĘ½ŗāĪüø½Įæ(Īüø½“ļĘ½ŗāŹ±µ„Ī»ÖŹĮæĪüø½¼ĮXĪüø½ÉéµÄÖŹĮæ)ČēĢā20Ķ¼-3ĖłŹ¾”£

¢ŁŌŚpH7~9Ö®¼ä,Īüø½¼ĮX¶ŌĪå¼ŪÉéµÄĘ½ŗāĪüø½ĮæĖępHÉżø߶ųŃøĖŁĻĀ½µ,ĘäŌŅņŹĒ______________”£
¢ŚŌŚpH4~7Ö®¼ä,Īüø½¼ĮX¶ŌĖ®ÖŠČż¼ŪÉéµÄČ„³żÄÜĮ¦Ō¶±ČĪå¼ŪÉéµÄČõ,ÕāŹĒŅņĪŖ___________”£ ĢįøßĪüø½¼ĮX¶ŌČż¼ŪÉéČ„³żŠ§¹ūæɲÉČ”µÄ“ėŹ©ŹĒ_________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖŃŠ¾æ»Æѧ·“Ó¦A+B![]() C+DµÄÄÜĮæ±ä»ÆĒéæö,ijĶ¬Ń§Éč¼ĘĮĖČēĶ¼ĖłŹ¾×°ÖĆ”£µ±ĻņŹ¢ÓŠAµÄŹŌ¹ÜÖŠµĪ¼ÓŹŌ¼ĮBŹ±,擵½UŠĪ¹ÜÖŠ¼×“¦ŅŗĆęĻĀ½µŅŅ“¦ŅŗĆęÉĻÉż”£ŹŌ»Ų“šĻĀĮŠĪŹĢā:
C+DµÄÄÜĮæ±ä»ÆĒéæö,ijĶ¬Ń§Éč¼ĘĮĖČēĶ¼ĖłŹ¾×°ÖĆ”£µ±ĻņŹ¢ÓŠAµÄŹŌ¹ÜÖŠµĪ¼ÓŹŌ¼ĮBŹ±,擵½UŠĪ¹ÜÖŠ¼×“¦ŅŗĆęĻĀ½µŅŅ“¦ŅŗĆęÉĻÉż”£ŹŌ»Ų“šĻĀĮŠĪŹĢā:
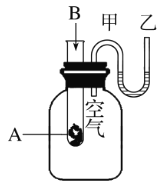
£Ø1£©øĆ·“Ó¦ĪŖ________(Ģī”°·ÅČČ”±»ņ”°ĪüČČ”±)·“Ó¦”£
£Ø2£©AŗĶBµÄ×ÜÄÜĮæ±ČCŗĶDµÄ×ÜÄÜĮæ_______(Ģī”°øß”±»ņ”°µĶ”±)”£
£Ø3£©ĪļÖŹÖŠµÄ______ÄÜ×Ŗ»Æ³É______ÄÜŹĶ·Å³öĄ“”£
£Ø4£©·“Ó¦Īļ»Æѧ¼ü¶ĻĮŃĪüŹÕµÄÄÜĮæ__________(Ģī”°øß”±»ņ”°µĶ”±)ÓŚÉś³ÉĪļ»Æѧ¼üŠĪ³É·Å³öµÄÄÜĮ攣
£Ø5£©Š“³öŅ»øö·ūŗĻĢāÖŠĢõ¼žµÄ»Æѧ·½³ĢŹ½:______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.½«±„ŗĶFeCl3ČÜŅŗµĪČėNaOHČÜŅŗÖŠ£¬ÄÜŠĪ³É½ŗĢå
B.Mg±ČAl»īĘĆ£¬øüŅ×ÓėNaOHČÜŅŗ·“Ӧɜ³ÉH2
C.Ė®ÕōĘųĶعż×ĘČȵÄĢś·ŪÓŠŗģŗÖÉ«¹ĢĢåÉś³É
D.¹¤ŅµÉĻÓĆ½¹ĢæŌŚøßĪĀĢõ¼žĻĀ»¹ŌŹÆÓ¢ÖĘČ”“Ö¹č
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com