
【题目】愈创木酚作原料合成香草醛的路线如图所示,下列说法正确的是( )
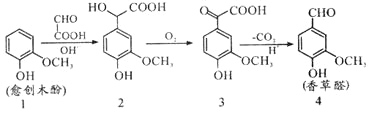
A.检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
B.化合物2在一定条件下可发生加聚反应
C.理论上反应1→2中原子利用率100%
D.等物质的量的四种物质与足量NaOH溶液反应,消耗NaOH物质的量比为1:3:2:1
【答案】C
【解析】
试题分析:A.香草醛与化合物3中都含有酚羟基,遇氯化铁溶液都变紫色,故A错误;B.化合物2分子中含有羧基、醇羟基,可以通过形成酯基发生缩聚反应生成高聚物,故B错误;C.由原子可知,化合物1HOOC-CHO的原子全部生成化合物2,没有其它物质生成,反应1→2中原子利用率为100%,故C正确;D.化合物1中酚羟基与NaOH反应,1mol化合物1含有1mol酚羟基,化合物2含有酚羟基、羧基与NaOH反应,1mol化合物2含有1mol酚羟基、1mol羧基,化合物3含有酚羟基、羧基与NaOH反应,1mol化合物3含有1mol酚羟基、1mol羧基,化合物4中含有酚羟基与NaOH反应,1mol化合物1含有1mol酚羟基,故1mol的化合物1、化合物2、化合物3、化合物4分别与足量NaOH反应,消耗NaOH物质的量之比为1mol:2mol:2mol:1mol=1:2:2:1,故D错误。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图。根据上述产业流程回答下列问题:
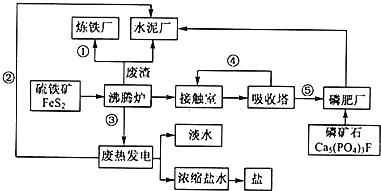
(1)从原料、能源、交通角度考虑该企业应建在______
A西部山区 B沿海地区 C发达城市 D东北内陆
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:①______、②______、③______、④______、⑤______。
(3)沸腾炉发生反应的化学方程式:______;磷肥厂的主要产品是普钙,其主要成分是______(填化学式)。
(4)热电厂的冷却水是______,该流程中浓缩盐水除提取盐以外还可提取的物质有______(写出一种即可)。
(5)根据现代化工厂没计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。______,______(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)为原料制备颜料铁红(Fe2O3)、晶体E,回收H和重金属混合物的生产工艺流程如图所示:
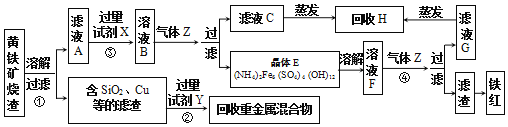
请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为__。Fe在周期表中的位置为第___周期第VIII族。
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是___。过程①溶解烧渣所需试剂中溶质的化学式为___。反应②的化学方程式:___。
(3)反应③的目的是___。气体Z的电子式:___。写出反应④的离子方程式:__。
(4)将回收的H溶于少量水,所得溶液中所有离子的浓度由大到小依次是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量铁的氧化铜制取氯化铜晶体(CuCl2xH2O)。有如下操作:
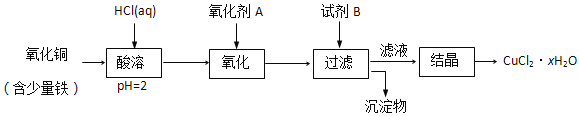
已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①加热酸溶过程中发生反应的化学方程式有:__。
②氧化剂A可选用___(填编号,下同)。
A.KMnO4 B.HNO3 C.Cl2
③要得到较纯的产品,试剂B可选用___。
A.NaOH B.CuO C.FeO
④试剂B的作用是___。
A.使Cu2+完全沉淀 B.使Fe3+完全沉淀 C.降低溶液的pH D.提高溶液的pH
⑤从滤液经过结晶得到氯化铜晶体的方法是__(按实验先后顺序选填编号)。
A.过滤 B.蒸发至干 C.冷却 D.蒸发浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,沸点为-5.5℃,遇水和潮气分解。
回答下列问题:
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制C12,Cu和稀HNO3制NO。
①制取NO的离子方程式为________________________
②选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口连接顺序为____(气流方向从左至右)。
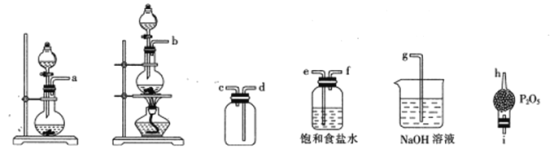
(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如下所示:
反应原理:NaNO2+2HCl=NOCl↑+NaCl+H2O。制取装置图:
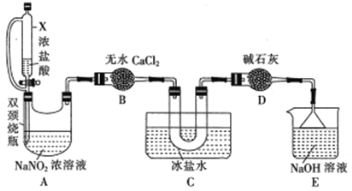
①仪器X的名称为_______,用它代替分液漏斗的优点是_________________
②装置C的U形管中观察到的现象是____________,装置D的作用是_________
(3)取少量产品NOCl滴入盛有水的试管中,液面上方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫
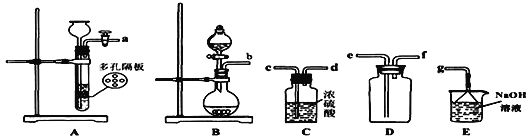
(1)写出实验室制SO2的化学方程式________________________________;
(2)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:_______________________________________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。
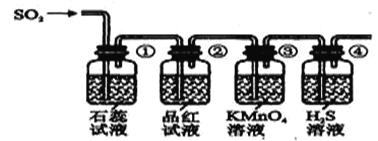
(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)用SO2漂白过的食品中一般残留有亚硫酸盐,科研小组设计了检验食品中是否含有亚硫酸盐的简单方法:将食品剪成碎末放入烧杯,加入适量的水,加热一会儿,冷却至室温,滴加盐酸和试剂A,观察液体的颜色变化既可。
①上述检验中试剂A是_____________。
②加热的作用是加快反应速率(或加快食品的溶解),加热时间不能太长的原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.聚氯乙烯分子能使溴水褪色
B.己烷共有4种同分异构体,它们的熔点、沸点各不相同
C.在一定条件下苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应
D.![]() 代表纯净物
代表纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是
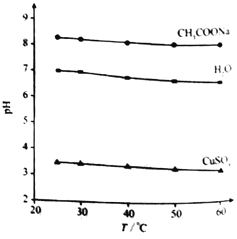
A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对阳极泥的综合处理可以回收贵重的金属,一种从铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
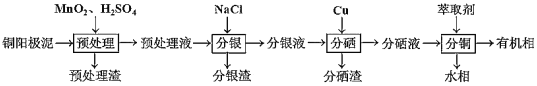
(1)已知预处理温度为80℃,预处理渣中几乎不含S元素,预处理时Cu2S发生反应的离子方程式为___,比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2做预处理剂的主要优点是___。
(2)回收分渣中的银,可用如下过程:
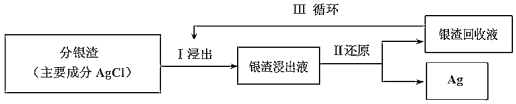
已知:S2O32-在碱性条件下很稳定,易与银离子络合:Ag++2S2O32-![]() Ag(S2O3)23-。常温下,络合反应的平衡常数为K稳[Ag(S2O3)23-]=2.8×1013,Ksp(AgCl)=1.8×10-10。
Ag(S2O3)23-。常温下,络合反应的平衡常数为K稳[Ag(S2O3)23-]=2.8×1013,Ksp(AgCl)=1.8×10-10。
①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O32-(aq)![]() Ag(S2O3)23-(aq)+Cl-(aq),常温下此反应的平衡常数K为___(结果保留二位小数)。
Ag(S2O3)23-(aq)+Cl-(aq),常温下此反应的平衡常数K为___(结果保留二位小数)。
②Ⅱ中还原剂为Na2S2O4,在碱性条件下进行反应生成Na2SO3,相应的离子反应方程式为:2Ag(S2O3)23-+S2O42-+4OH-=2Ag+4S2O32-+2SO32-+2H2O,所以Ⅲ中的银渣回收液可直接循环使用,但循环多次后银的浸出率会降低,请从化学平衡移动的角度分析原因___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亚硒酸(H2SeO3)。
①已知常温下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-4,则NaHSeO3溶液的pH__7(填“>”、“<”或“=”)。
②二元强酸硒酸(H2SeO4)可以用电解亚硒酸溶液的方法制得,电解时的阳极反应式为___。
(4)分铜得到产品CuSO45H2O的具体操作如下:
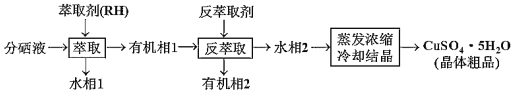
①萃取与反萃取原理为:2RH+Cu2+![]() R2Cu+2H+,反萃取剂最好选用__(填化学式)溶液。
R2Cu+2H+,反萃取剂最好选用__(填化学式)溶液。
②蒸发浓缩需用小火加热至溶液表面出现__为止,再冷却结晶即可得到产品CuSO45H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com