
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能达到相应实验目的的是
选项 | A | B | C | D |
实验目的 | 除去KCl中少量MnO2 | 用10 mol·L-1盐酸配制100mL0.1 mol·L-1盐酸 | 用含有少量NH4Cl杂质的NaCl溶液制备氯化钠晶体 | 制乙炔的发生装置 |
实验仪器或装置 | 烧杯、玻璃棒、分液漏斗 | 100 mL容量瓶、玻璃棒、烧杯 |
|
|
A. A B. B C. C D. D
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】硝酸与金属反应,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。

[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示
b.NO2沸点:21 ℃;NO沸点:-151 ℃
c.2NO2+2OH-===NO![]() +NO
+NO![]() +H2O,NO+NO2+2OH-===2NO
+H2O,NO+NO2+2OH-===2NO![]() +H2O
+H2O
(1)请写出Mg放入10 mol·L-1硝酸中反应的化学方程式:______________________;
[实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
(2)a仪器的名称是_____________。
(3)前一个C装置的作用是_______,证明气体产物中有NO生成的实验现象是______。
(4)从后一个C装置中逸出的气体是________。
(5)某同学测想A溶液中可能还有一种还原产物NH4NO3,请设计实验验证他的猜想_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。
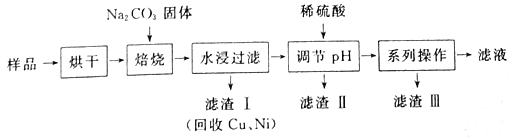
已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物质
②除去滤渣II后,溶液中存在反应2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
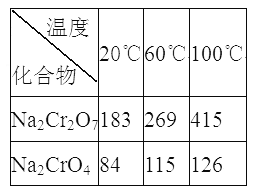
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
(1) “焙烧”过程中生成NaAlO2化学方程式为_____________________。
(2)生成滤渣II时,需加入适量稀硫酸调节溶液的pH除去A1O2-。若稀硫酸过量,则过量后引起反应的离子方程式为______________________。
(3) “系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_____________,滤渣III的主要成分是_________(填化学式)。
(4)工业上还可以在“水浸过滤’’后的溶液中加人适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为______________。
(5)流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20mL,水稀释至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol L-1的FeSO4溶液进行氧化还原滴定,到终点时消耗FeSO4溶液体积为V mL,则“滤液”中的c(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。
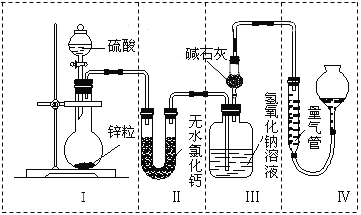
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_________________。
A.200 mL B.300 mL C.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为______;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是________;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)=_____;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.对于有气体参加的反应增大压强能提高活化分子的浓度
B.升高温度增大了活化分子百分数
C.催化剂能够改变化学反应途径
D.具有较高能量的反应物分子一定能发生有效碰撞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中的下列做法正确的是( )
A.用明矾做自来水的消毒剂
B.废弃的干电池不能随意丢弃,但可以土埋处理
C.用电解NaCl溶液来制备金属钠
D.电工操作中,不能把铜线和铝线拧在一起连接线路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A. 稀有气体
B. 金属元素和非金属元素分界线附近的元素
C. 右上方区域的非金属元素
D. 左下方区域的金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于下图所示电化学装置的分析正确的是

A. 若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜
B. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护
C. 若X为电流计,Y为锌棒,则SO42-移向Fe棒
D. 若X为导线,Y为铜棒,则Fe棒发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com