
| A. | 加入FeCl3浓溶液或固体后,溶液颜色加深 | |
| B. | 加入少量KCl固体,增大了生成物浓度,平衡向逆反应方向移动,溶液颜色变浅 | |
| C. | 滴加几滴NaOH溶液,有红褐色沉淀生成,溶液颜色加深 | |
| D. | 加入几滴AgNO3溶液,有白色沉淀生成,溶液颜色加深 |
分析 A、加入FeCl3浓溶液或固体后,平衡正向移动,导致溶液颜色加深;
B、根据实际参加反应的离子浓度分析,平衡为:Fe3++3SCN-?Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变;
C、Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低;
D、加入几滴AgNO3溶液,银离子与氯离子结合成氯化银白色沉淀,但溶液浓度减小,颜色变浅.
解答 解:A、加入FeCl3浓溶液或固体后,增加反应物的浓度平衡正向移动,导致溶液颜色加深,故A正确;
B、反应FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl的离子方程式为Fe3++3SCN-?Fe(SCN)3,所以平衡中加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动,溶液红色不变,故B错误;
C、Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低,平衡向逆反应方向移动,试管内溶液颜色变浅,故C错误;
D、加入几滴AgNO3溶液,银离子与氯离子结合成氯化银白色沉淀,但溶液浓度减小,颜色变浅,而不是加深,故D错误;
故选:A.
点评 本题考查学生对平衡移动原理的理解,比较基础,注意反应中实际参加反应的离子浓度分析,其中的钾离子与氯离子未参加离子反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
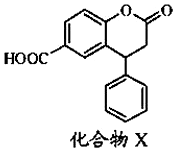
| A. | X的分子式为C15H10O4 | |
| B. | 分子中有3种含氧官能团 | |
| C. | X分子中3个六元环可能处于同一平面 | |
| D. | 即能发生酯化反应,又能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,先将上层液体从上口倒出 | |
| B. | 萃取时,振荡后,须打开活塞放气 | |
| C. | 蒸馏时,先点燃酒精灯,后通冷凝水 | |
| D. | 蒸发时,将溶剂蒸干一段时间后,熄灭酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HSO3溶液中,加入过量的氢氧化钠溶液,并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向次氯酸钠溶液中通入少量SO2气体:2ClO-+SO2+H2O=2HClO+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 135 g•mol-1 | B. | 99.5g•mol-1 | C. | 67.5 g•mol-1 | D. | 64 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以惰性电极电解饱和食盐水阴极:Na++e-═Na | |
| B. | 用铜电极电解CuSO4溶液)阳极:Cu═Cu2++2e- | |
| C. | 以惰性电极电解熔融NaCl阴极:Na++e-═Na | |
| D. | 以惰性电极电解NaOH溶液阳极:4OH-═2H2O+O2↑+4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属氧化物 氧化铁 FeO | B. | 酸性氧化物 二氧化硫 SO2 | ||
| C. | 酸 硫酸 H2SO4 | D. | 碱 纯碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
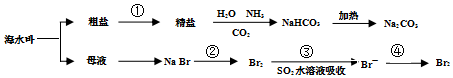
| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第②、④步骤中,溴元素均被氧化 | |
| D. | 制取NaHCO3的反应中,利用了其溶解度在相同条件下小于NaCl的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com