
 表示的分子式C6H14,结构简式(CH3)2CHCH2CH2CH3,名称是2-甲基戊烷.
表示的分子式C6H14,结构简式(CH3)2CHCH2CH2CH3,名称是2-甲基戊烷. 科目:高中化学 来源: 题型:选择题
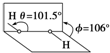 我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )| A. | 任何分子式中的“•”都表示氢键 | |
| B. | H2O2是极性分子,其结构简式为HO-OH | |
| C. | H2O2既有氧化性又有还原性 | |
| D. | H2NCONH2与H2O2是通过氢键结合的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 4:1:3 | C. | 2:5:2 | D. | 2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应① | 反应② |
| A | 向AgNO3溶液中滴加稀盐酸 | AgNO3溶液与食盐水混合 |
| B | 过量CO2通入NaOH溶液中 | 过量CO2通入澄清石灰水中 |
| C | 向烧碱溶液中滴加稀盐酸 | 向H2SO4溶液中滴加KOH溶液 |
| D | 向BaCl2溶液中滴加稀硫酸 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
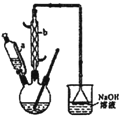 己二酸
己二酸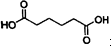 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下: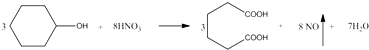
| 物质 | 密度(g/cm3) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.360/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 | 146 |
查看答案和解析>>
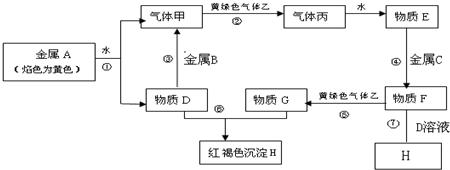
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子沿导线由Cu片流向Ag片 | |
| B. | 正极的电极反应是Ag++e-=Ag | |
| C. | Cu片上发生氧化反应,Ag片上发生还原反应 | |
| D. | 反应时盐桥中的阳离子移向Cu(NO3)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com