
| A. | K+、Al3+、OH-、Cl- | B. | H+、Mg2+、NO3-、SiO32- | ||
| C. | Fe3+、NH4+、SCN-、F- | D. | Na+、Cu2+、NO3-、SO42- |
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素的原子序数依次递增.已知:
A、B、C、D、E、F六种元素的原子序数依次递增.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
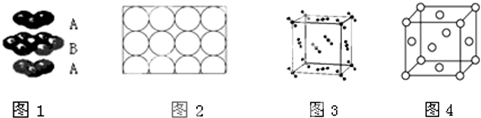
| A. | 钛和钾都采取图1的堆积方式 | |
| B. | 图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积 | |
| C. | 图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个 | |
| D. | 图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝钠合金是混合物 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| D. | 若mg不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
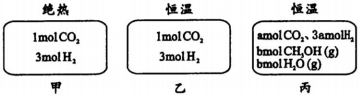
| A. | 刚开始反应时速率:甲>乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com