
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:湖南省蓝山二中2011-2012学年高二上学期期中考试化学试题 题型:022
在温度、容积相同的甲、乙、丙3个密闭容器中,投入的反应物分别是:
甲
1 mol N2、3 mol H2;乙2 mol NH3;丙4 mol NH3.保持恒温、恒容,反应达到平衡.(已知N2(g)+3H2(g)=2NH3(g) ΔH=-92.0 kJ·mol-1)
(1)甲、乙、丙3个容器中达到平衡时NH3的浓度分别为
c1 mol·L-1、c2 mol·L-1、c3 mol·L-1.则c1________c2;2c1________c3(填大于、等于或小于)(2)如果甲中N2的转化率是20﹪,那么甲中H2的转化率为________,乙中NH3的转化率为________.
(3)容器甲中反应的能量变化是放出18.4 kJ,那么容器乙中反应的能量变化是________kJ;(要注明是放出还是吸收)
查看答案和解析>>
科目:高中化学 来源:福建省永安一中2011-2012学年高二上学期期中考试化学试题 题型:058
Ⅰ.合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol据此回答以下问题:
(1)为了提高氨气的产率,可以选择的方法是________(填序号,错选扣分).
①升高温度
②增大压强
③使用催化剂
④及时分离出NH3
(2)对在密闭容器中进行的可逆反应:N2(g)+3H2(g)![]() 2NH3(g),下列哪种情况下,说明该反应已经达到化学平衡状态________.
2NH3(g),下列哪种情况下,说明该反应已经达到化学平衡状态________.
①N2的正反应速率是NH3的逆反应速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1∶3∶2
④单位时间内每生成3 mol H2的同时有2 mol NH3生成
⑤3 mol N-N键断裂,同时有6 mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(ΔH>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________(选填序号).

Ⅱ.(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如下表所示:

该实验的目的是________;表中V1=________mL.
(2)可逆反应C(s)+H2O(g)![]() H2(g)+CO(g),ΔH>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如下图.
H2(g)+CO(g),ΔH>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如下图.
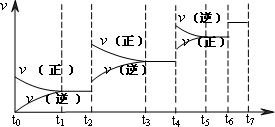
①图中t4到t6段时引起平衡移动的条件可能是________;
②图中表示平衡混合物中CO的含量最高的一段时间是________.
查看答案和解析>>
科目:高中化学 来源:教材完全解读 苏教版课标版 高中化学 必修1 苏教版课标版 题型:022
化合物E(含两种元素)与NH3反应,生成化合物G和H2.化合物G的相对分子质量约为81,G分子中硼元素(B的相对原子质量为10.8)和氢元素的质量分数分别是40%和7.4%,由此推断:
(1)化合物G的化学式为________.
(2)反应消耗1 mol NH3,可生成2 mol H2,组成化合物E的元素是________和________.
(3)1 mol E和2 mol NH3恰好完全反应,化合物E的化学式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分) 按要求填空
(1)配平下列化学方程式:并用单线桥标出电子转移的方向和数目。
______Fe3O4 + ______CO = _____Fe +_______CO2
(2)检验SO42-所需要用的试剂__________________和__________________。
(3)三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(4)0.3 mol NH3 分子中所含质子数与________个H2O分子中所含质子数相等。
查看答案和解析>>
科目:高中化学 来源:2014届山东省济宁市高一上学期期中质量检测化学试卷 题型:实验题
(10分)某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________________.
此方案第一步的实验装置如下图所示:
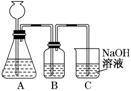
(2)加入反应物前,如何检验整个装置的气密性:________________________ ________________________________________________
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是_____ _,作用是_____________________________________________
(4)在实验室通常制法中,装置A还可作为下列______ (填序号)气体的发生装置.
①HCl ②H2 ③O2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_______ mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com