
| A、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):c(NH4)2SO4>c(NH4HSO4)>c(NH4C1) |
| B、向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、pH=6的纯水:c(H+)>c(OH-) |
| D、1.0mol/LNa2CO3溶液:c(OH-)=c(H+)+c(H2CO3)+c(HCO3-) |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| A、0.22mol |
| B、0.24mol |
| C、0.52mol |
| D、0.65mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 g Fe和一定量的浓HNO3或稀硝酸完全反应,转移电子均为0.3 NA | ||
| B、16 g氧气或臭氧的氧原子个数均为NA | ||
| C、标准状况下的4.48L的乙烯或己烷所含的分子数均为0.2NA | ||
D、28.6 g Na2CO3?10H2O在晶体中或溶液中,含有的CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮气的结构式:N-N | ||
B、含有126个中子的铋原子:
| ||
C、过氧化钠电子式: | ||
D、氦原子核外电子的运动状态: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na+、Fe2+、Cl-、SO
| ||||||
B、K+、Na+、[Al(OH)4]-、NO
| ||||||
C、Ba2+、Na+、NO
| ||||||
D、NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2的比例模型为 | ||
B、质子数为53、中子数为72的碘原子为
| ||
| C、乙烯的结构式为CH2=CH2 | ||
| D、KHCO3的电离方程式为KHCO3═K++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
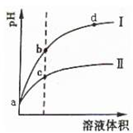 某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )
某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如图所示.据图判断下列叙述中,正确的是( )| A、曲线Ⅰ为醋酸稀释时溶液pH变化曲线 |
| B、加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多 |
| C、a点时,加入少量相同大小的锌粒,与盐酸反应的速率大 |
| D、b点溶液中水的电离程度比c点溶液中水的电离程度大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com