
| Ԫ�� | �����Ϣ |
| A | AԪ��ԭ�Ӻ���ֻ�������ܼ�����ÿ���ܼ��Ϻ�����ȵĵ����� |
| B | �ǿ����к�����ḻ��Ԫ�� |
| C | �������У�����C�Ľ�������ǿ |
| D | ��̬ԭ�ӵ����ܲ�����7���˶�״̬��ͬ�ĵ��� |
| E | һ�ֺ��ص�������Ϊ63��������Ϊ34 |




| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ԭ���е����Ӻ����� |
| B��C2H4�����е����Ӻ͵��� |
| C��Na2O2�����е������Ӻ������� |
| D��������,pH��7��CH3COOH��CH3COONa�����Һ�е�H+��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����һ�����ܣ�O��N��C |
| B������ǿ����HNO3��H2CO3��HClO |
| C���⻯�����ȶ��ԣ�NH3��PH3��SiH4 |
| D��ԭ�Ӱ뾶��С˳��r (Mg)��r (Al)��r (N) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
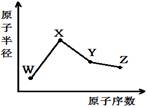
| A��������XZW�Ⱥ����Ӽ�Ҳ�����ۼ� |
| B����Ӧ��̬�⻯����ȶ���Y��Z |
| C����Ӧ�����Ӱ뾶��X��W |
| D��Y������������Z��X������������Ӧ��ˮ���ﷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A�����Ӽ� | B�����Թ��ۼ� | C���Ǽ��Թ��ۼ� | D�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
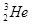 �˾۱����ͷų��������൱��Ŀǰ����һ�����ĵ��������ڵ����Ϻ�Ԫ����Ҫ��
�˾۱����ͷų��������൱��Ŀǰ����һ�����ĵ��������ڵ����Ϻ�Ԫ����Ҫ��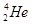 ����ʽ���ڡ��йظ�Ԫ��˵����ȷ����
����ʽ���ڡ��йظ�Ԫ��˵����ȷ����A��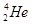 ԭ�Ӻ�����4������ ԭ�Ӻ�����4������ |
B��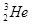 �� ��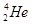 ��Ϊͬλ�� ��Ϊͬλ�� |
C��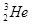 ԭ�Ӻ�����3������ ԭ�Ӻ�����3������ |
D��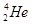 �����ֻ��2�����ӹʾ��н�ǿ�Ľ����� �����ֻ��2�����ӹʾ��н�ǿ�Ľ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��TIԪ����һ������Ԫ�� |
| B��TIԪ�ص����ԭ��������204 |
| C����Ԫ�ص���������204.4 |
| D��TIԭ���������3��������ͬ�ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ƶ���
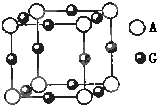 ��������٤������ΪNA���û����ᄃ����ܶ�Ϊ a g/cm3���侧���ı߳�Ϊ cm��
��������٤������ΪNA���û����ᄃ����ܶ�Ϊ a g/cm3���侧���ı߳�Ϊ cm���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com