
| A. | 某酸性溶液中可能大量存在:NH4+、Fe3+、NO3-、I- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液中,Al3+、Cl-、Ba2+、NO3-一定不能大量共存 | |
| C. | 向NH3•H2O溶液中滴加少量AlCl3溶液,发生反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向含有1 mol FeBr2的水溶液中通入标准状况下11.2 L Cl2,发生反应:Cl2+2Fe2+═2Fe3++2Cl- |
分析 A.硝酸根离子在酸性环境下具有强的氧化性;
B.由水电离的c(H+)=10-12 mol•L-1的溶液,可能为酸性溶液或者是碱性溶液;
C.不符合反应客观事实;
D.二价铁离子还原性强于溴离子,氯气少量先氧化二价铁离子.
解答 解:A.硝酸根离子在酸性环境下具有强的氧化性,能够氧化碘离子,不能大量共存,故A不选;
B.碱性溶液中,铝离子不能大量共存,故B不选;
C.一水合氨为弱碱,与氯化铝反应生成氢氧化铝沉淀和氯化铵,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C不选;
D.向含有1 mol FeBr2的水溶液中通入标准状况下11.2 L Cl2,氯气少量先氧化二价铁离子,发生反应:Cl2+2Fe2+═2Fe3++2Cl-,故D选;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质、离子方程式书写方法是解题关键,注意反应物用量对反应的影响,注意二价铁离子与溴离子还原性强弱顺序,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:C2H5OH、Na+、MnO4-、NO3- | |
| B. | 溶有二氧化硫气体的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| C. | 加入铝产生H2的溶液:Na+、K+、HCO3-、AlO2- | |
| D. | 常温下,水电离c(H+)=1×10-10mol•L-1的溶液:Al3+、Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能发生氧化反应 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 由乙酸和乙醇制乙酸乙酯与由苯制取硝基苯反应属于同一类型的反应 | |
| D. | 苯和乙烷都能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| B. | 纯碱溶液中滴加少量盐酸:CO32-+H+=HCO3- | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H=Fe2++H2S↑ | |
| D. | NH4HCO3溶于过量的NaOH溶液中:HCO3+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
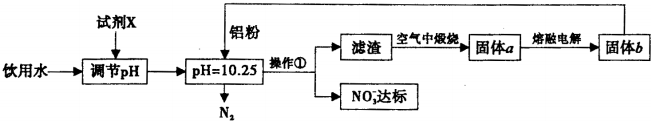
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com