
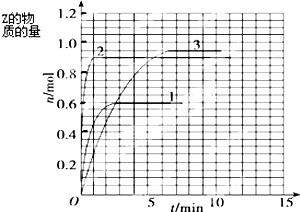
 ij�¶�ʱ����10L�ܱ���������̬����X��Y��Ӧ������̬����Z�����ǵ����ʵ�����ʱ��ı仯�±������ݣ�
ij�¶�ʱ����10L�ܱ���������̬����X��Y��Ӧ������̬����Z�����ǵ����ʵ�����ʱ��ı仯�±������ݣ�| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
| ת��Ũ�� |
| ��ʼŨ�� |
| ת��Ũ�� |
| ��ʼŨ�� |
| 1.0-0.55 |
| 1.0 |


 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��C3H8��C4H6O2 |
| B��C2H6��C2H6O |
| C��C2H2��C6H6 |
| D��C3H6O��C3H8O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
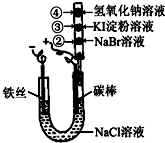 ij��ѧ��ȤС�鰴��ͼ��ʾ��װ�ý���ʵ�飬��������װ�е��в�ͬ��Һ�İ�ɫ����ʵ������У����������������ɣ�������˵��������ǣ�������
ij��ѧ��ȤС�鰴��ͼ��ʾ��װ�ý���ʵ�飬��������װ�е��в�ͬ��Һ�İ�ɫ����ʵ������У����������������ɣ�������˵��������ǣ�������| A��̼���ĵ缫��ӦʽΪ2Cl--2e-=Cl2�� | ||||
| B���ڴ����۴���ɫ����ֱ��Ϊ�Ȼ�ɫ����ɫ | ||||
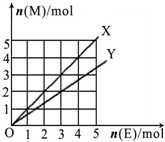
C����ͼX��Y�����߷ֱ��ʾ�����ķǽ������ʺͽ������ʣ���M��ʾ����̼�������ﵥ��E�ڵ�ȼ�����½��л��Ϸ�Ӧ�����ʵ���֮��Ĺ�ϵ��д������Y�߷�Ӧ�Ļ�ѧ��ʽMg+Cl2
 | ||||
| D����20��ʱ����ʳ��ˮ����������Ϊ26%������������1.12L����״���£�����ʱ��Cl-��ȫ�ŵ磮�Լ���Ҫʹ��Һ�ָ�ԭ״̬�������3.65gHCl���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Һ��pH=a��������Һϡ��1������Һ��pH=b����a��b | ||
| B�����ʵ���Ũ�Ⱦ�Ϊ0.01 mol?L-1��CH3COOH��CH3COONa�Ļ����Һ�У�c��CH3COOH��+c��CH3COO-��=0.01mol?L-1 | ||
| C��1.0��10-3 mol?L-1�����pH=3.0��1.0��10-8mol?L-1�����pH=8.0 | ||
D��0.1mol?L-1�Ĵ�����Һ�еμ������ռ���Һ����Һ��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȡ� | |
| 500 | 800 | ||
| ��2H2��g��+CO��g��?CH3OH��g�� | K1 | 2.5 | 0.15 |
| ��H2��g��+CO2��g��?H2O ��g��+CO��g�� | K2 | 1.0 | 2.50 |
| ��3H2��g��+CO2��g��?CH3OH��g��+H2O ��g�� | K3 | ||
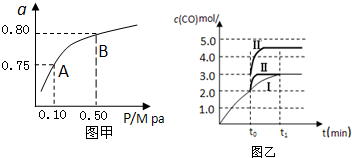
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| A�������ⷴӦ��NH3BH3�������� |
| B��NH4BO2��NH3BH3������ȫ��ͬ�Ļ�ѧ�� |
| C��0.1 mol NH3BH3���������ⷴӦ����������6.72 L H2 |
| D��Ԫ��N�ĵ�һ�����ܸ�������Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������������Է���������С������ |
| B��1molCH4�ڹ����������������4molCl2��Ӧ |
| C������Ķ��ȴ���ֻ��һ�ֿ���֤������Ϊ��������ṹ |
| D������������������Ϊ1��2ʱ���������ȼ��ը����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
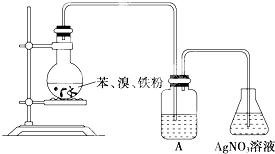
| A��ˮ |
| B��NaOH��Һ |
| C��CCl4 |
| D��NaI��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com