
给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是
A.Mg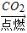 C
C SO3
SO3
B.0.1mol•L-1HCl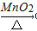 Cl2
Cl2 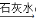 Ca(ClO)2(aq)
Ca(ClO)2(aq)
C.NaCl饱和溶液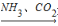 NaHCO3
NaHCO3 Na2CO3
Na2CO3
D.淀粉溶液 葡萄糖
葡萄糖 Cu2O
Cu2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届四川省宜宾县高三第一次适应性测试理综化学试卷(解析版) 题型:选择题
二氧化锰是常用的催化剂、氧化剂和活性电极材料。海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
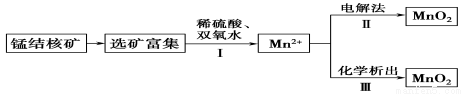
已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰。下列推断不正确的是( )
A.反应Ⅰ的离子方程式为MnO2+H2O2+2H+===Mn2++2H2O+O2↑
B.反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O===MnO2↓+4H+
C.若加入KClO3,则反应Ⅲ为2ClO+5Mn2++4H2O===5MnO2↓+Cl2↑+8H+
D.若加入KMnO4,则反应Ⅲ为3Mn2++2MnO+2H2O===5MnO2↓+4H+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南嘉积中学高二下期中理科化学试卷(解析版) 题型:填空题
某芳香烃A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为_____________;
(2)A与溴的四氯化碳溶液反应的化学方程式为_____________,反应类型是_____________;
(3)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式_____________;
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为_____________;
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:填空题
氢能是一种极具发展潜力的清洁能源,硫碘循环制氢主要的热化学方程式为:
Ⅰ.SO2(g)+2H2O(l)+I2(g)=H2SO4 (l)+2HI(g) △H=35.9 kJ/mol
Ⅱ.2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=470kJ/mol
Ⅲ.2HI(g)=H2(g)+I2(g) △H=14.9kJ/mol
(1)反应2H2(g)+ O2(g)=2H2O(l)的△H= mol·L-1。
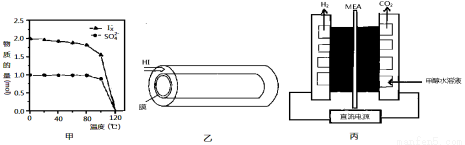
(2)反应Ⅰ在液相中发生称为bensun反应,向水中加入1mol SO2和3mol I2,在不同温度下恰好完全反应生成的n(SO42-)和n(Ix-)的变化见图甲。
①Ix-中x= 。②温度达到120℃时,该反应不发生的原因是 。
(3)反应Ⅲ是在图乙中进行,其中的高分子膜只允许产物通过,高分子膜能使反应程度 ___ (填“增大”、“减小”或“不变”),在该装置中为了进一步增大达平衡时HI的分解率;不考虑温度的影响,还可以采取的措施为 。
(4)图丙是一种制备H2的方法,装置中的MEA为允许质子通过的电解质膜。
①写出阳极电极的反应式: 。
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 操作 | 现象 | 结论 |
A | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2中一定含Fe3+ |
B | 从煤油中取出一小块钠,用滤纸擦净表面的煤油,放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
C | 将某气体通入品红溶液 | 溶液褪色 | 气体一定是SO2 |
D | 向NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-结合H+的能力比CO3-强 |
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.分子式为C2H4O2的有机物不一定有酸性
B.当物质中的化学键发生断裂时,一定发生化学变化
C.等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2
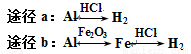
D.只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:实验题
工业废铁屑(含有一些不溶于酸的杂质)为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,其主要流程如下:
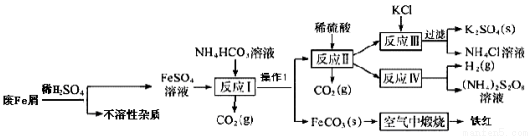
(1)反应I加入NH4HCO3的作用是除去过量的酸,还有一个作用是____________;
(2)反应I需控制反应温度低于35℃,其目的是____________,操作①名称是____________,检验反应Ⅱ溶液中阳离子的方法是____________;
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是____________;
(4)己知FeCO3的Ksp=2×10-11,反应I中Fe2+完全沉淀后,溶液中c(CO32-)=____________;
(5)写出FeCO3在空气中锻烧的化学反应方程式____________;
(6) NH4C1溶液显酸性,其浓溶液可用于除去铁锈,其原理是(用离子反应方程式表示)____________。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:选择题
A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B处在同一周期,A、C处在同一主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层上的电子数是D原子最外层电子数的3倍。下列说法中正确的是
A.简单离子半径:D>B
B.气态氢化物的稳定性:A>B
C.B、D两元素可组成阴、阳离子个数比为1:1的化合物
D.B、C、D三种元素可组成化学式为DCB2的化合物,其水溶液显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com