
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
分析 ①求出 Na2CO3晶体的物质的量,然后根据碳酸钠由2个钠离子和1个碳酸根构成来分析;
②O3和O2均由氧原子构成;
③一个胶体粒子由多个氯化钠构成;
④N2和O2均为双原子分子.
解答 解:①106gNa2CO3晶体的物质的量为1mol,而碳酸钠由2个钠离子和1个碳酸根构成,故1mol碳酸钠中含2mol钠离子和1mol碳酸根,故共含3NA个,故错误;
②O3和O2均由氧原子构成,故16g混合物中含有的氧原子1mol,即NA个,故正确;
③一个胶体粒子由多个氯化钠构成,故形成的胶粒的个数小于0.1NA个,故错误;
④N2和O2均为双原子分子,故1mol氮气和氧气的混合物中含有的原子个数为2NA个,故正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )| A. | d电极:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol | |
| C. | Ⅱ中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
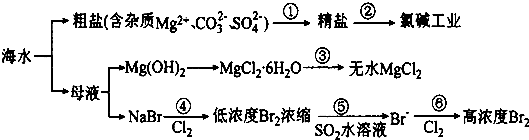
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br一需消耗2.24LCl2 | |
| D. | 在过程③中将MgCl2.6H2O灼烧即可制得无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
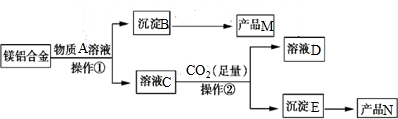
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于二元酸H2X,若NaHX溶液呈酸性,则H2X为强酸 | |
| B. | 升高温度,Na2A溶液的pH增大,H2A为弱酸 | |
| C. | 向烧碱溶液中通人CO2,一定存在c(Na+)=c(CO32-)+c(HCO3-)+c(H2C03) | |
| D. | 常温下,稀释氢氟酸溶液,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )
如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )| A. | 关闭分液漏斗的活塞.将干燥管末端放人水中,微热烧瓶,有气泡从水中冒出,停止加热后,燥管内有水柱形成,表明装置不漏气 | |
| B. | 若装置用于制取氯气并验证其具有漂白性,则A中所用试剂为稀盐酸,B中所用药品为KMnO4固体,C中为品红溶液 | |
| C. | 若装置用于制取SO2并验证其具有漂白性,则A中所用试剂为浓硫酸,B中所用药品为Na2SO3固体,C中为酸性KMnO4溶液 | |
| D. | 若实验时B中盛放固体NaOH,A中为浓氨水,C中为稀AgNO3溶液,则实验过程中,C试管中看不到明显的实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
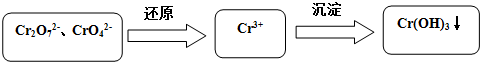
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、Na2SO4、NaCl | B. | NaCl、Na2SO4、NaOH | ||
| C. | NaOH、NaCl、Na2SO4 | D. | Na2SO4、NaOH、NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com