
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①③ |
分析 ①碳不完全燃烧放热少,焓变包含负号比较大小;
②固体硫变为气态硫需要吸收热量;
③反应热的数值与物质的物质的量成正比;
④碳酸钙分解吸热焓变为正值,氧化钙和水反应是化合反应放热,焓变是负值.
解答 解:①碳不完全燃烧放热少,焓变包含负号比较大小,所以△H1<△H2,故①错误;
②S的燃烧是放热反应,所以△H<0,固体硫变为气态硫需要吸收热量,所以△H1>△H2,故②正确;
③H2的燃烧是放热反应,所以△H<0,反应热与物质的物质的量成正比,即2△H1=△H2,所以△H1>△H2,故③正确;
④碳酸钙分解吸热焓变为正值,氧化钙和水反应是化合反应放热,焓变是负值,所以△H1<△H2,故④错误;
故选:B.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H-H键3NA | |
| B. | 46 g Na与0.5 L 2 mol•L-1盐酸充分反应,转移电子数为2NA | |
| C. | 8.4 g固体NaHCO3中,含有阳离子0.2NA | |
| D. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
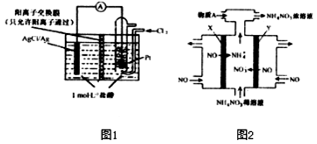 氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
氧化还原反应与生产、生活、科技密切相关,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
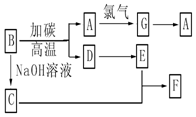 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
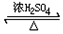 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
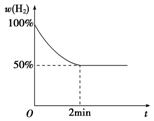 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com