
.某强氧化剂XO(OH)2+被Na2SO3还原。如果还原2.4×10-3mol XO(OH)2+,需用30mL 0.2mol/L的Na2SO3溶液,那么X元素被还原后的价态是
A.+2 B.+1 C.0 D.-1
科目:高中化学 来源: 题型:
已知:某温度时,KW=1.0×10-12。在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-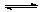 H++A2-
H++A2-
B.常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-)
C.相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等
D.0.0l mol·L-l的NaHA溶液pH>2
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
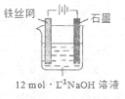
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O 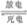 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组对离子方程式xR2+ + yH+ + O2 = mR3+ + nH2O的分析研究,下列说法中错误的是
A.根据电荷守恒,得出x与y的和一定等于m
B.根据原子守恒,得出x和m的数值一定相等
C.根据电子得失守恒,得出x=4的结论
D.根据氧化还原反应关系得出:R2+是还原剂, O2是氧化剂, R3+是氧化产物, H2O是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
、三氟化氮(NF3)是无色无味气体,它可由氨气和氟气反应制得:4NH3+3F2===NF3+3NH4F。下列说法正确的是
A、NH4F的还原性比NH3强
B、NF3的氧化性比F2强
C、该反应中被氧化和被还原物质的物质的量之比为4∶3
D、该反应中得到1 mol NF3时,转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
写出符合要求的化学方程式或离子方程式:
(1)实验室用二氧化锰和浓盐酸制备氯气的离子方程式_______________________________。
(2)用苯制备硝基苯的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:

(1)电解生成的铝在熔融液的 (填“上层”或“下层”),电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式: 。
(3)电解制 备铝时,需加入冰晶石(Na3AlF6),其作
备铝时,需加入冰晶石(Na3AlF6),其作 用是 ,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式: 。
用是 ,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式: 。
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是 (填化学式),阳极的电极反应为  。
。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见下图),此时铝表面可形成耐酸的致密氧化膜,其电极反应为 ;

②钢材镀铝后,能防止钢材腐蚀,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com