
已知溶液中存在平衡:Ca(OH)2 (s) 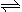 Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
A.升高温度,固体的量减少
B.加入少量Na2CO3粉末能增大钙离子的浓度
C.降低温度,溶液中c(OH-)增大
D.恒温下加入少量CaO,溶液的pH增大
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:填空题
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z_________W(填“>”、“<”或“=”,后同);电负性:X________Y。
(2)写出Q的价电子排布图_____________,YF3的结构式_____________,
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:答:________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上学期12月月考化学试卷(解析版) 题型:选择题
下列离子方程式的书写正确的是
A、铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
B、钠和冷水反应 Na+2H2O=Na++2OH?+H2↑
C、氢氧化钡溶液与稀 H2SO4 反应:Ba2++2OH―+SO42-+2H+=BaSO4↓+2H2O
D、NaHCO3溶液与Ca(OH)2溶液反应: OH― + HCO3- = CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列过程发生化学变化的是
A.酒香扑鼻 B.蜡烛照明 C.用金刚石切割玻璃 D.太阳能供热
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:填空题
有①CH3COOH;②HCl;③H2SO4 三种酸。
(1)CH3COOH溶液中,其电离平衡常数表达式为K = _________________
(2)0.1 mol/L的三种酸溶液,c(H+)由大到小的排列顺序是 (填序号)。
(3)体积相同、c(H+)相同的三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是 (填序号)。
(4)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为___________;
(5)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热量,则醋酸溶液中,醋酸电离的热化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上期末考试化学试卷(解析版) 题型:填空题
Ⅰ在右图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极。
①断开K2接通K1时,为_____________极,b电极上的电极反应式为________________;
②断开K1时接通K2,a为_____________极;该电极上的电极反应式是____________一段时间后,溶液的pH_________(填“增大”、“减小”或“不变”)
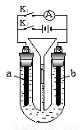
Ⅱ、双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。
a气体为______________,B溶液为________________;C隔膜为____________(阳离子交换膜、阴离子交换膜),该电解反应的总方程式可表示为_______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:选择题
m molC2H2跟n molH2在密闭容器内反应,当其达到平衡时,生成p molC2H6。将平衡混合气体完全燃烧,所需O2物质的量是
A.(3m+n)mol B.(  )mol C.(3m+n+2p)mol D.
)mol C.(3m+n+2p)mol D. 
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上期末(理)化学试卷(解析版) 题型:填空题
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中,
(1)氧化剂是 ,氧化产物是 。
(2)被氧化与未被氧化的HCl的质量之比为 ,若有7.3gHCl被氧化,产生Cl2的体积(标况下)为 L,转移电子 mol。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期末考试化学试卷(解析版) 题型:填空题
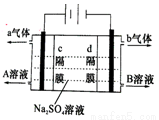
海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
(一)某化学研究小组用右图装置模拟步骤I电解食盐水(用铁和石墨做电极)。
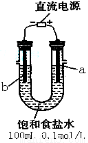
(1)a电极材料是 (填铁、石墨),其电极反应式为 。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为 (忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。下表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是______________(填序号,下同),加入
调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是: 。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是 。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com