
| A. | CO 2分子比例模型: | B. | S 2-的结构示意图: | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | D. | HCN分子的结构式:H-C≡N |
分析 A.碳原子半径大于氧原子;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;
C.元素符号的左上角标质量数,质量数=质子数+中子数;
D.书写结构简式时注意C≡N三键不能省略.
解答 解:A.碳原子半径大于氧原子,其正确的比例模型为 ,故A错误;
,故A错误;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,故B错误;
,故B错误;
C.氯元素的质子数为17,中子数为20的氯原子的质量数为37,该原子正确的表示方法为:1737Cl,故C错误;
D.HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故D正确.
故选D.
点评 本题考查了化学用语的判断,属于基础知识的考查,题目难度中等,注意掌握常见有机物的表示方法,试题考查了学生规范答题的能力.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CCl4所含原子数目为2.5NA | |
| B. | 常温常压下,64g SO2中含有的原子数为3NA | |
| C. | 将1 mol Cl2通入水中能生成1mol HClO | |
| D. | 2L 0.1 mol•L-1K2SO4溶液中含K+物质的量为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
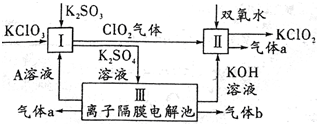 氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.
氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、OH- | B. | Na+、NO3-、Cl- | ||
| C. | K+、H+、HCO3- | D. | Ca2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现代化学元素分析测试中,可用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素,用红外光谱仪确定物质中是否存在某些有机原子团,用原子吸收光谱确定物质中含有哪些金属元素等 | |
| B. | 钠钾合金在常温下是液体,可用于快中子反应堆作剂;镁合金大量用于制造火箭、导弹和飞机的部件等 | |
| C. | 2015年浙江省多地遭遇雾霾天气,有报道称雾霾颗粒中汽车尾气占20%以上,一致汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质,其中PM2.5(OM单位为百万分之一米)颗粒大小约等于胶体粒子 | |
| D. | 如图所示为四大基本反应及其关系,则反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O属于区域3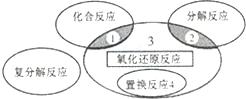 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
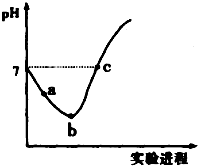 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )| A. | 向a 点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b 点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a 点到b 点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$ 减小 | |
| D. | c 点所示溶液中:c(Na+ )=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、AlO2-、ClO- | ||
| C. | Fe2+、Na+、Cl-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
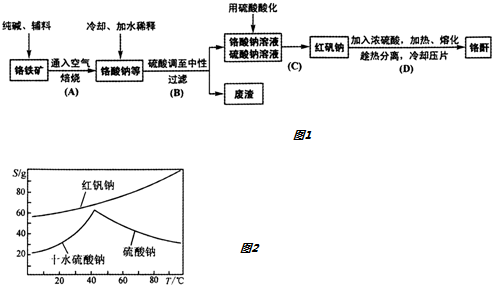
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com