
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( ) 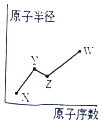
A.Y、Z、W处于同一周期
B.X、Y、Z、W的原子序数递增
C.X、W可形成化学式为XW的离子化合物
D.简单离子半径是Z大于W
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

实验步骤:
在A中加入4.4 g的异戊醇、6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是______。
(2)在洗涤操作中,第一次水洗的主要目的是____________,第二次水洗的主要目的是___________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后______(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________________。
(5)实验中加入少量无水MgSO4的目的是___________。
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填标号)。

(7)本实验的产率是______(填标号)。
a.30℅ b.40℅ c.60℅ d.90℅
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__(填“高”或“低”), 原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 若将15P原子的电子排布式写成1s22s22p63s23p3p,它违背了泡利原理
B. 金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
C. 石墨、新型高分子导电材料、聚乙烯、金属晶体均含有金属键
D. 乳酸[CH3CH(OH)COOH]中存在2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能加快反应速率的主要原因是( )
A. 活化分子能量明显增加 B. 降低活化分子百分数
C. 增加活化分子百分数 D. 降低反应所需要的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | MgO | MnO | CaO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2- )为_____nm,r(Ca2+)为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为__________。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中中心离子是_________,配体分子的价层电子对互斥模型________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K,沸点为376K,则Ni(CO)4固体属于晶体____________,1mol Ni(CO)4含有的配位键数目为_______。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78 pm,则熔点NiO__________FeO(填“>”“<”或“=”),原因是_____________。
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为___________,有___________%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a= _______________pm。(写出计算表达式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是
选项 | 需除杂的物质 | 试剂 | 操作 |
A | Fe2O3(Al2O3) | Na OH溶液 | 过滤 |
B | CO2(HCl) | Na OH溶液 | 将气体通过洗气瓶 |
C | NaCl(Na2CO3) | 稀硫酸 | 蒸发结晶 |
D | Mg(Al) | 氨水 | 过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D、E为中学化学常见的金属单质且D常呈红色,F是一种黑色晶体。E与C的浓溶液在常温作用呈钝化现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图:

(1)已知1g E在B中燃烧放出的热量为Q kJ,试写出表示E燃烧的热化学方程式____;
(2)用惰性电极电解一定浓度的A的水溶液,阳极反应式为_____________________,通电一段时间后,向所得溶液中加入8.0g D的氧化物后恰好恢复到电解前的浓度,则电解过程中收集到标准状况下的气体体积为_____________升。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com