
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
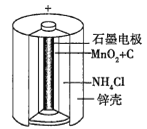
(1)锌锰干电池是应用最普遍的电池之一,如图为锌锰干电池的构造示意图,锌锰干电池的负极材料是________(填物质名称),负极发生的电极反应为_____________。若反应消耗32.5 g负极材料,则电池中转移电子的数目为________。
(2)目前常用的镍镉(Ni-Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
①该电池可以在酸性条件下进行充、放电
②该电池放电时,负极的电极反应式为Cd-2e-+2OH-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能
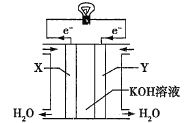
(3)如图为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的________(填“正”或“负”)极,X极的电极反应式为_________。
【答案】锌 Zn-2e-=Zn2+ 6.02×1023 ②④ 负 H2-2e-+2OH-=2H2O
【解析】
(1)负极上锌失电子发生氧化反应;先计算Zn的物质的量,然后根据Zn是+2价的金属计算Zn转移电子的物质的量;
(2)该电池放电时为原电池,充电时为电解池,放电时能自发进行,充电时需要外加电源;
(3)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极为正极,该燃料电池中,Y电极上氧气得电子和水反应生成氢氧根离子。
(1)负极发生氧化反应,锌失去电子,电极反应式为Zn-2e-=Zn2+,32.5g锌的物质的量为n(Zn)=![]() =0.5 mol,而1 molZn反应失去2 mol电子,所以32.5 g锌参与反应时转移电子的物质的量为1 mol,转移的电子数目约为6.02×1023;
=0.5 mol,而1 molZn反应失去2 mol电子,所以32.5 g锌参与反应时转移电子的物质的量为1 mol,转移的电子数目约为6.02×1023;
(2)①根据电池反应原理可知,因为该电池在碱性条件下进行充、放电,①错误;
②因为电池在放电时,负极Cd失去电子,产生的Cd2+与OH-结合形成Cd(OH)2,电极反应式为:Cd-2e-+2OH-=Cd(OH)2,②正确;
③该电池放电时,Cd电极失去电子,发生氧化反应,电极反应式为:Cd-2e-+2OH-=Cd(OH)2,可见Cd电极的质量会增加,③错误;
④该电池放电时,是将化学能转化为电能,④正确;
故合理选项是②④;
(3)该燃料电池中,通入氢气的电极X为负极,由于电解质为KOH碱性环境,所以负极X上H2失去电子产生的H+与OH-结合形成H2O,故负极X的电极反应式为H2-2e-+2OH-=2H2O。


科目:高中化学 来源: 题型:
【题目】利用生活中或实验室中的常用物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(__、__)、稀硫酸、__、__耳机(或电流计).
(3)①按如图所示装置连接好实验仪器,这时可以听见耳机发出“嚓嚓……”的声音。其原因是在原电池中化学能转化为__,在耳机中__又转化为声波这种能量。
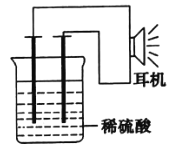
②在该原电池内中,Fe在___极发生了___反应,H+在___极发生了___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用pH试纸验证醋酸是弱酸。甲、乙两同学的方案分别是
甲:①准确配制0.1mol·L-1的醋酸钠溶液100mL;
②用pH试纸测出该溶液的pH,即可证明醋酸是弱酸。
乙:①量取一定量的冰醋酸准确配制pH=1的醋酸溶液100mL;
②取醋酸溶液1mL,加水稀释为10 mL;
③用pH试纸测出②中溶液的pH,即可证明醋酸是弱酸。
(1)两个方案的第①步中,都要用到的定量仪器是______________________,简要说明pH试纸的使用方法:______________________________。
(2)甲方案中,说明醋酸是弱酸的理由是测得醋酸钠溶液的pH________(选填“<”“>”或“=”,下同)7,乙方案中,说明醋酸是弱酸的理由是测得醋酸溶液的pH________2。
(3)请你评价乙方案的不妥之处:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】央视焦点访谈节目曾报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如下图所示,下列说法正确的是( )
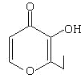
A.该有机物的分子式为C7H6O3
B.1mol该有机物最多能与2molH2发生加成反应
C.该有机物的一种芳香族同分异构体能发生银镜反应
D.该有机物能发生取代、加成、氧化和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A. 选择合适的试剂,用图1装置可分别制取和收集少量CO2、NO 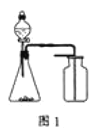
B. 除去石英(主要成分SiO2)中少量碳酸钙:用稀盐酸溶解后过滤
C. 洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干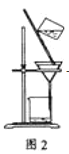
D. 用广泛pH试纸测得0.1molL-1NH4Cl溶液的pH=5.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指在一段时间内任何一种反应物物质的量浓度的减少或任何一种生成物物质的量浓度的增加
B.化学反应速率可以衡量化学反应进行的快慢
C.化学反应速率为![]() 是指在某1s时的速率是
是指在某1s时的速率是![]()
D.对于任何化学反应来说,反应速率越快,反应现象越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 准确量取25.00mL的液体可选用移液管、量筒或滴定管等量具
B. 实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗
C. 用分液漏斗分液时要经过振荡、放气、静置后,从上口倒出上层液体,再打开旋塞,将下层液体从下口放出
D. 在中和热测定实验中,盐酸和NaOH溶液的总质量mg,反应前后体系温度变化为t,反应液的比热容为![]() ,则生成1mol水放出的热量为
,则生成1mol水放出的热量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为基本原料制备聚乙烯和乙酸。下列说法正确的是( )
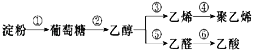
A.淀粉和葡萄糖都是营养物质,均能在体内发生水解、氧化反应
B.工业上以石油为原料制取聚乙烯,需经裂解、加聚等反应
C.燃烧等物质的量的乙烯和乙醇耗氧量不同
D.乙醇和乙酸发生酯化反应制乙酸乙酯,原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A. 已知工业合成氨的正反应方向放热,所以升温正反应速率降低,逆反应速率升高
B. 实验室用H2O2分解制备O2,加入MnO2后,反应速率明显加快
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com