
X、Y、Z分别代表3种不同的短周期元素,X元素的原子最外层电子数为1,Y元素原子M层有6个电子,Z元素原子的L层电子数6,由这三种元素组成的化合物的化学式是
A. X3YZ4 B. X2YZ3 C. XYZ4 D. X4YZ4
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源:2016-2017学年江苏省苏州市高一上学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中可能大量共存的是
A. FeCl3溶液中:K+、Na+、SO42-、SCN-
B. 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3-
C. 漂白粉溶液中:K+、Na+、I-、CO32-
D. 与铝反应产生氢气的溶液中:Na+、K+、CO32-、OH-
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长白山市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
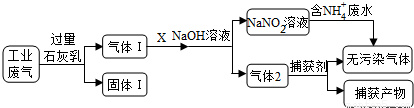
(1)固体I中主要成分为__________,捕获剂所捕获的气体主要是_________。
(2)处理含NH4+废水时,发生反应的离子方程式为___________。
(3)若X为适量空气,严格控制空气用量的原因是____________。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________。
增加压强,NO的转化率__________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:选择题
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A. 与W相邻的同主族元素可制成重要的半导体材料
B. X单质不可能置换出W单质
C. 元素原子半径从大到小的顺序是X、Y、Z
D. W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:实验题
某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品a g,称量时应该使用的主要仪器的名称是___________。
(2)将样品溶解于足量的稀盐酸,过滤。滤液中主要含有___________, 滤渣中含有____________,溶解、过滤用到的玻璃仪器是_________________。
(3)滤液中加过量NaOH 溶液、过滤。有关的离子方程式是______________。
(4)步骤(3)中的滤液中通入足量的CO2气体,可产生沉淀,过滤。有关的离子方程式是________________________________________________。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称量,其质量是b g,原样品中铝的质量分数为____________________。
(6)若步骤(3)中加入NaOH的量不足,则实验结果偏______(填“高”“低”或“无影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
X、Y、Z、W四种短周期元素,若:①X的阳离子与Y的阴离子具有相同的电子层结构,②W的阳离子的氧化性强于同主族带等电荷数的X的阳离子的氧化性,③Z的阴离子半径大于同主族带等电荷数的Y的阴离子半径,则这四种元素的原子序数由大到小的顺序为( )
A. W>Y>X>Z B. Z>Y>W>X C. X>Y>Z>W D. Z>X>Y>W
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
下列关于铜的说法不正确的是( )
A. 铜长期放置在潮湿的空气中容易生锈,生成Cu(OH)2
B. 铜丝在氯气中燃烧生成CuCl2而与硫反应生成Cu2S,说明氧化性Cl2 > S
C. CuO不及Cu2O稳定,高温条件下CuO可以分解生成Cu2O和氧气
D. 蓝色的CuSO4·5H2O可以受热分解转化为白色的CuSO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列物质性质的递变关系正确的有
①稳定性:HCl>H2S>PH3 ②离子半径:O2->F->Na+>Mg2+>Al3+
③碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 ④最高化合价:Cl>Si>Al>F
⑤沸点:HF>HCl>HBr>HI
A. ①②④⑤ B. ①②④ C. ①②⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省抚顺市高三3月模拟考试理科综合化学试卷(解析版) 题型:简答题
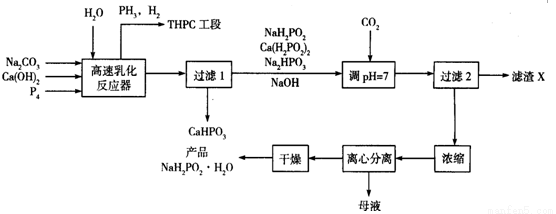
化学镀镍是指不使用外加电流,利用氧化还原作用在金属制件的表面上沉积一层镍的方法。次磷酸钠(NaH2PO2)是化学镀镍的重要原料,工业上制备NaH2PO2·H2O的流程如下:
回答下列问题:
⑴次磷酸钠(NaH2PO2)是次磷酸(H3PO2)与足量NaOH溶液反应的产物,NaH2PO2属于_______(填“正盐”“酸式盐”“碱式盐”), NaH2PO2中磷元素的化合价为___________。
(2)在反应器中加入乳化剂并高速搅拌的目的是________________
(3)在反应器中发生多个反应,其中白磷(P4)与Ca(OH)2反应生成次磷酸钠及磷化氢的化学方程式为_________________________
(4)流程中通入CO2的目的是______________,滤渣X的化学式为_____________
(5)流程中母液中的溶质除NaH2PO2外,还有的一种主要成分为_____________
(6)含PH3的废气可用NaClO和NaOH的混合溶液处理将其转化为磷酸盐,该反应的离子方程式为____________
(7)某次生产投入的原料白磷为1240 kg,在高速乳化反应器中有80%的白磷转化为次磷酸钠及磷化氢,忽略其它步骤的损失,理论上最终得到产品NaH2PO2·H2O的质量应为__________kg(NaH2PO2·H2O的相对分子质量为106)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com