
【题目】(1)配平方程式 KMnO4+ HCl(浓)- KCl+ MnCl2+ Cl2↑+ H2O,并用双线法分析此反应;___。
(2)指出___是氧化剂,___元素被氧化,氧化产物是___,此反应中,HCl表现的性质有___性和___性。
【答案】 KMnO4 Cl Cl2 还原(酸) 酸(还原)
KMnO4 Cl Cl2 还原(酸) 酸(还原)
【解析】
反应中锰元素化合价+7价变化为+2价,电子转移5e-,氯元素化合价-1价变化为0价,电子转移2e-,电子转移总数为10e-,结合原子守恒、电荷守恒和电子守恒配平书写;根据物质的性质解析。
(1)反应中锰元素化合价+7价变化为+2价,电子转移5e-,氯元素化合价-1价变化为0价,电子转移2e-,电子转移总数为10e-,结合原子守恒、电荷守恒和电子守恒配平书写标记电子转移的化学方程式为: ;
;
(2)化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,其中KMnO4是氧化剂、HCl是还原剂,部分氯元素被氧化,HCl中部分起酸性作用,没有发生氧化反应,此反应中,HCl表现的性质有酸性和还原性。


科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )
nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( B )
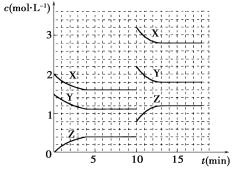
A. 反应方程式中n=1
B. 10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D. 0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。
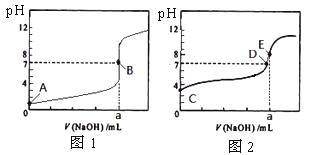
若以HA表示酸,下列说法正确的是
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C. 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D. 当0 mL<V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)>c(H+) >c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO![]() 、Cl-、SO42-
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO![]()
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H—Cl键的同时生成4 mol H—O键
D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。
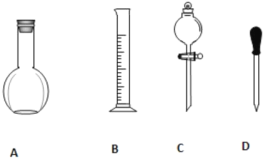
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学知识回答下列问题:
(1)AlCl3溶液呈______性(填“酸”“中”“碱”)原因是_________________________(用离子方程式表示);若把AlCl3溶液蒸干,灼烧,最后主要得到固体产物是________;若将AlCl3溶液和NaHCO3溶液混合,该反应的离子方程式为__________________________________________。
(2)将1L0.2 mol·L-1HA溶液与1L0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同)。
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
(3)常温下,若NaOH溶液中c(OH—)与NH4Cl溶液中c(H+)相同,现将NaOH溶液和NH4Cl溶液分别稀释10倍,稀释后NaOH溶液和NH4CI溶液的pH分别用pH1和pH2表示。则pH1 +pH2________(填“>”“<”或“=”)14。
(4)pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量
请回答下列问题:
(1)该实验的目的是_________________
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g若要将所称取的样品恰好溶解,最多需要蒸馏水____________g,溶解样品所需的仪器是________________
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
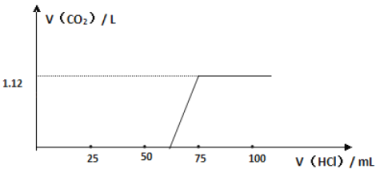
则13.3 g 该样品中未变质的NaOH的质量为____________;NaOH的变质程度为_________(用质量分数表示);与NaOH反应消耗的盐酸体积为________mL
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像,他们从实验中还发现了什么问题?_____________________,并由此得出了什么结论?____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液
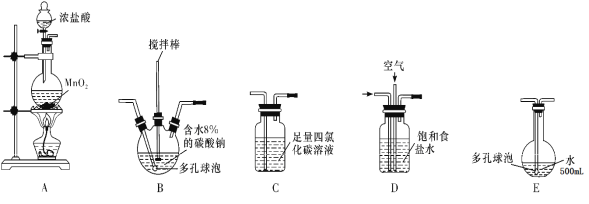
回答下列问题:
(1)各装置的连接顺序为____→_____→_____→____→E;
(2)装置 A 中反应的离子方程式是__________________;
(3)装置 E中反应的化学方程式是_____________________;
(4)装置 B 中多孔球泡和搅拌棒的作用是____,反应过程中,装置B需放在冷水中,其目的是____。
(5)装置C的主要作用是_____________________;
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)______________。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
(8)配平下列离子方程式:______Fe(OH)3+ ClO![]() + OH
+ OH![]() — FeO42-+ Cl-+ H2O。
— FeO42-+ Cl-+ H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com