
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2.Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的![]() 倍,试回答:
倍,试回答:
(1)X元素的名称: ,Y元素在元素周期表中的位置 ,Z元素的原子结构示意图 .
(2)Y2X对应水化物的电子式 ,其中存在的化学键有 .
(3)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因 .
【答案】(1) 氧;第三周期IA族;
(2)![]() ;离子键、共价键
;离子键、共价键
(3)H2O分子之间存在氢键
【解析】试题分析:Z原子有2个电子层,最外层电子数是核外电子数的![]() 倍,令最外层电子数为a,则
倍,令最外层电子数为a,则![]() (2+a)=a,解得a=4,所以Z为C元素;设X原子的质子数为x,Y原子的质子数为y,三种元素原子的质子总数为25,则有6+x+y=25,Z和Y的原子序数之和比X的原子序数2倍还多1,则有6+y=2x+1,联立方程解得:x=8,y=11,即X为氧元素,Y为钠元素。
(2+a)=a,解得a=4,所以Z为C元素;设X原子的质子数为x,Y原子的质子数为y,三种元素原子的质子总数为25,则有6+x+y=25,Z和Y的原子序数之和比X的原子序数2倍还多1,则有6+y=2x+1,联立方程解得:x=8,y=11,即X为氧元素,Y为钠元素。
(1)由上述分析可知,X为氧元素,Y为钠元素,处于周期表中第三周期IA族,Z为碳元素,原子结构示意图为: 。
。
故答案为:氧;第三周期IA族; ;
;
(2)Y2X为Na2O,对应水化物为NaOH,其电子式为:![]() ,含有离子键、共价键。
,含有离子键、共价键。
故答案为:![]() ;离子键、共价键;
;离子键、共价键;
(3)H2O分子之间存在氢键,比同主族的氢化物的熔沸点明显偏高。
故答案为:H2O分子之间存在氢键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
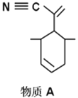
(2)四(三苯基膦)钯分子结构如右图:P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为______;判断该物质在水中溶解度并加以解释_________________________________________。该物质可用于如图所示物质A的合成:物质A中碳原子杂化轨道类型为________________;一个A分子中手性碳原子数目为_______________。
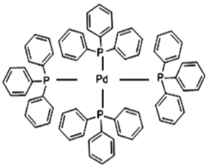
(3)在图示中表示出四(三苯基膦)钯分子中配位键
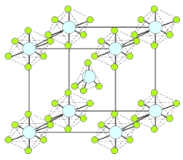
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为 ;正四面体形阳离子中键角小于PCl3的键角原因为____________________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
反应Ⅱ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②反应Ⅰ中,若△H1﹤0,则要提高甲醇的产率,可采取的措施有_____(填字母)
A.缩小容器的体积 B.降低温度 C.升高温度
D.使用合理的催化剂 E.将甲醇从混合体系中分离出来
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1453kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-466kJ/mol
请写出32g甲醇液体发生不完全燃烧生成一氧化碳和液态水的热化学反应方程式: 。
Ⅱ.由CO2和H2合成CH3OH的反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H。在10L的恒容密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
CH3OH(g)+H2O(g)△H。在10L的恒容密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
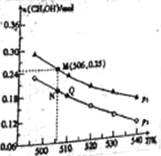
①上述反应的△H (填“﹥”或“﹤”)0
②图中压强p1 (填“﹥”或“﹤”)p2
③经测定知Q点时容器的压强是反应前压强的0.9,若反应从开始到平衡所需的时间为10min,则0~10min内H2的反应速率v(H2)= 。
④N点时,该反应的平衡常数K= (计算结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ·mol-1
H3=198 kJ·mol-1
反应ZnS(s) + C(s) + 2O2(g)=Zn(g) + CO2(g) + SO2(g)的![]() H4= kJ·mol-1。
H4= kJ·mol-1。
(2)反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H﹤0
CO(NH2)2(s)+H2O(g)△H﹤0
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
若想提高氨气的转化率,可以采取的措施有 (写出两条)
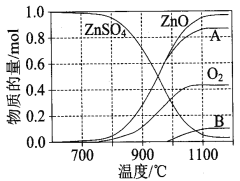
(3)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
①700℃~980℃时发生反应中生成物质二氧化硫、ZnO和氧气,如该反应在2L密闭容器内进行,10min时,测得生成的氧气的物质的量为0.3mol,则这段时间二氧化硫的生成速率为 。
② 硫酸锌分解生成的SO2经下图中的循环可得到H2SO4。循环中电解过程阳极反应式是 。
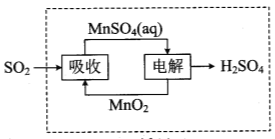
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2。具体生产流程如下:
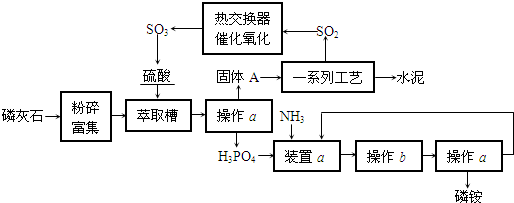
回答下列问题:
(1)装置a用磷酸吸收NH3.若该过程在实验室中进行,请画出装置a的示意图.___________;
(2)热交换器是实现冷热交换的装置.化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是___________;
(3)依题意猜测固体A中一定含有的物质的化学式是___________(结晶水部分不写).
(4)利用生产磷铵排放的废渣磷石膏制取硫酸,其中SO2生产硫酸的工艺流程图如图所示:
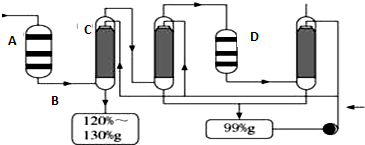
①在A处二氧化硫被氧化成三氧化硫,设备A的名称是___________,设备A中发生反应的化学方程式是___________,为提高三氧化硫的产率,该处应采用___________(填“等温过程”或“绝热过程”)为宜。
②在D处进行二次催化处理的原因是___________;
③B处气体混合物主要是氮气和三氧化硫。此时气体经过C后不立即进入D是因为:___________;
④20%的发烟硫酸(SO3的质量分数为20%)1吨需加水___________吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.能用于测定硫酸尾气中SO2含量的是___________(选填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)△H=﹣57kJmol﹣1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化
N2O4(g)△H=﹣57kJmol﹣1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化
的曲线如图所示。下列说法正确的是( )
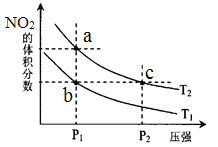
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:

(1)方框内装置用来制取乙烯,其中包括的仪器和药品是:
①碎瓷片 ②石棉网和铁架台 ③圆底烧瓶 ④温度计(量程100℃)⑤温度计(量程200℃)⑥酒精灯 ⑦单孔塞 ⑧双孔塞⑨导管。不选用的仪器有 (填编号)。
写出制乙烯化学方程式:_____________________________,反应进行一段时间后,方框内装置中混合液常变黑,并伴有刺激性气味的气体产生,该气体是 ,若要验证有该气体生成,应将生成的气体通过 溶液。
(2)NaOH溶液的作用是___________________,碱石灰的作用是:_____________________。
(3)实验过程中,发现溴水会褪色,可能的原因是:________ _____。
(4)出现什么现象可说明生成了乙烷?_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水生产的流程示意图见下:
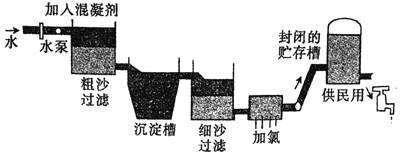
(1)二氧化氯(ClO2)是一种高效、安全的水处理剂,比C12好。有如下两种制备C1O2方法:
方法一:2NaClO3+4HCl=2C1O2↑+Cl2↑+2NaCl+2H2O
方法二:2NaC lO3 +H2O2+H2SO4=2C lO2↑ +Na2SO4十O2↑+2H2O
用方法二制备的C1O2更适合用于饮用水消毒,其主要原因是__________。
C1O2和C12在消毒时自身均被还原为Cl-, C1O2的消毒能力是等质量Cl2的_________倍
(2)含有较多的钙、镁离子的水被称为硬水。暂时硬水最常见的软化方法是_________。
永久硬水一般可以使用离子交换树脂软化,先把水通过装有_________ (填“阴”或“阳”)离子交换树脂的交换柱,再通过另一种功能的离子交换树脂。使用后的阳离子交换树脂可以置于_________中再生。
(3)水处理中常见的混凝剂有硫酸铝、聚合氛化铝、硫酸亚铁、硫酸铁等。硫酸亚铁作为混凝剂在除去悬浮物质时,需要将水的pH调至9左右,原因是_________。
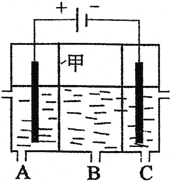
(4)电渗析法是一种利用离子交换膜进行海水淡化的方法.下图是电渗析法的示意图,淡水从_________(填“A”、“B”或,“C”)口流出,甲为_________离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘草甜素在治疗丙肝、艾滋病、非典等疾病方面有一定疗效。甘草甜素在一定条件下可转化为甘草次酸。下列有关说法正确的是

A. 甘草甜素转化为甘草次酸属于酯的水解
B. 在Ni催化作用下,1mol 甘草次酸最多能与3molH2发生加成反应
C. 甘草甜素中含有羧基、羰基、碳碳双键、酚羟基等官能团
D. 甘草甜素、甘草次酸均可与Na2CO3、溴水等无机试剂发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com