
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是_。反应过程__(填“①”或“②”)的能量变化可用图表示。

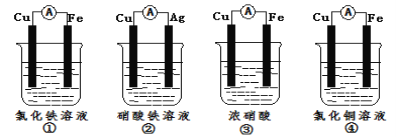
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_(填序号)。
(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中_(填A或B)处电极入口通甲烷,当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为__mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为__。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的负极反应式为__。
【答案】放 扩大接触面积,提高反应速率 ① ② A 10.8 2H++2e-═H2↑ Al+4OH-﹣3e-=AlO2-+2H2O
【解析】
(1)反应①温度升高,说明是放热反应;反应②将固体研细,可以增大接触面积,提高反应速率;示意图中的反应物的总能量高于生成物的总能量,为放热反应的能量变化图,与①吻合;故答案为:放;扩大接触面积,提高反应速率;①;
(2)①的总反应为:Fe+2Fe3+=3Fe2+,Fe3+的氧化性强于Fe2+,不符合,①错误;
②的总反应为:Cu+2Fe3+=Cu2++2Fe2+,Fe3+的氧化性强于Cu2+,符合,②正确;
③的总反应为:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑,NO3-的氧化性强于Cu2+,不符合,③错误;
④的总反应为:Fe+Cu2+=Cu+Fe2+,Cu2+的氧化性强于Fe2+,不符合,④错误;
答案为:②;
(3)根据示意图,a极失电子,则a极为负极,b极为正极,燃料通入燃料电池的负极,所以,A处电极入口通甲烷,负极的反应式为:CH4+10OH--8e-=CO32-+7H2O, ,n=10.8mol,故答案为:A;10.8;
,n=10.8mol,故答案为:A;10.8;
(4)①电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,构成Al-Cu-H2SO4原电池,Cu作正极,H+在正极得电子生成H2,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②电极c为Al、电极d为Mg,电解质溶液为氢氧化钠溶液时,构成Al-Mg-NaOH原电池,Al作负极,电极反应式为:Al+4OH-﹣3e-=AlO2-+2H2O,故答案为:Al+4OH-﹣3e-=AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2 min,D的平均反应速率为0.2 mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡不移动
D. 增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝水溶液呈_____性,原因是(用离子方程式表示)________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是___________(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③ 已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2kJ ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________。
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_______、 _______ 、 _________。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,有![]() 盐酸;
盐酸;![]() 硫酸;
硫酸;![]() 醋酸三种酸的稀溶液
醋酸三种酸的稀溶液![]() 用a、b、c、
用a、b、c、![]() 、
、![]() 、
、![]() 号填写
号填写![]()
![]() 当其物质的量浓度相同时,
当其物质的量浓度相同时,![]() 由大到小的顺序是____________,
由大到小的顺序是____________,
![]() 同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________,
同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________,
![]() 当其
当其![]() 相同时,物质的量浓度由大到小的顺序为____________,
相同时,物质的量浓度由大到小的顺序为____________,
![]() 当
当![]() 相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气
相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气![]() 相同状况
相同状况![]() ,则开始时反应速率的大小关系是____________.
,则开始时反应速率的大小关系是____________.
![]() 将
将![]() 相同的三种酸均加水稀释至原来的10倍,
相同的三种酸均加水稀释至原来的10倍,![]() 由大到小的顺序为_____________.
由大到小的顺序为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算:
(1)2 mol尿素[CO(NH2)2]含__个H原子,所含氧原子跟_____g H2O所含氧原子个数相等。
(2)2.4g 镁中含______mol电子,在与足量盐酸反应中产生标准状况下的氢气体积为 ______L。
(3)30.9gNaR含有Na+ 0.3mol,则NaR的摩尔质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图2表示反应中的能量变化;图1表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图2表示反应中的能量变化;图1表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图2”中,曲线__(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H=_________。
(2)从反应开始到建立平衡,v(CO)=_______;达到平衡时,c(H2)=_____,该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为_____________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡__________移动(填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为_____________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡__________移动(填“正向”、“逆向”或“不”)。
(3)恒容条件下,下列措施中能使n(CH3OH)/n(CO)增大的有___________.
a.升高温度 b.充入He气 c.再充入2molH2 d.使用催化剂.
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓释布洛芬是常用的解热镇痛药物,其一种合成路线如下:

已知:① 
② R1COOR2 + R3OH ![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)按照官能团分类,A所属的类别是______。
(2)反应①的化学方程式是______。
(3)试剂X的结构简式是______。
(4)F→G的反应类型是______。
(5)H的结构简式是______。
(6)反应②的化学方程式是______。
(7)缓释布洛芬能缓慢水解释放出布洛芬,请将下列方程式补充完整。
 + 2n H2O
+ 2n H2O![]() ______
______
(8)以丙烯为起始原料制备丙酮酸甲酯(![]() )的合成路线如下,请补充完整(无机试剂任选)。_____
)的合成路线如下,请补充完整(无机试剂任选)。_____
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com