
合理利用二氧化碳,可以提高生活质量,促进工业发展。
(1)在常压下,-78 ℃时,二氧化碳气体凝结成固态二氧化碳,俗称干冰。某学生买回一盒冰淇淋月饼,盒里有很多作为致冷剂的碎干冰。下列关于干冰处理的正确做法是( )
A.将干冰放入冰箱 B.让干冰在通风处自然升华
C.直接将干冰倒入下水道 D.用手取干冰扔入废物箱
(2)在采煤工业上,把干冰与炸药放在一起,既能增强爆炸威力,又能防止火灾,能增强爆炸威力的原因是______________;能防止火灾的原因是______________。
(3)使用传统催化剂,使二氧化碳与某些有机物反应可以生成塑料,但反应时间长。目前诞生的纳米级催化剂增加了催化剂的表面积,提高了_________。使用这种塑料能减少白色污染,因为它在微生物作用下,可以实现100%的_________。
科目:高中化学 来源: 题型:
浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
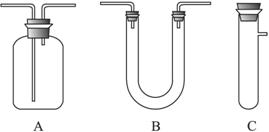
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④
C.③④ D.②③

查看答案和解析>>
科目:高中化学 来源: 题型:
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
 ;
;
(2)写出“联合制碱法”有关反应的化学方程式:
;
;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
 ;
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上对海水资源综合开发利用的部分工艺流程如下图所示。
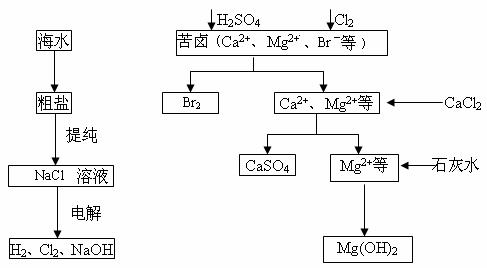
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子是______________。电解槽中的阳极材料为__________________。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2和CaSO4的顺序制备?______________________原因是______________________。
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X 的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;Z元素在周期表中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)
;V、W的氢化物分子结合H+能力较强的是(写化学式) ;用一个离子方程式加以证明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是

| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是_________________________。
装置C中的烧瓶需要加热,其目的是_____________________________________。
②反应一段时间后,装置D中观察到的现象是______________________________________,装置D不能采用普通玻璃管的原因是____________________________________,装置D中发生反应的化学方程式为__________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_________________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和结论都正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入KSCN溶液和盐酸,溶液变红色 | 原溶液一定含Fe3+ |
| B | 向某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 原溶液一定含CO32- |
| C | 向某溶液中加入稀盐酸无现象,再滴加BaCl2有白色沉淀 | 原溶液一定含SO42- |
| D | 向某溶液滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液一定不含NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com