
| A. | H2A是弱酸 | |
| B. | 稀释0.1mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大 | |
| C. | 在0.1mol/L的H2A溶液中,c(H+)=0.12mol/L | |
| D. | 若0.1mol/L的NaHA溶液中c(H+)=0.02mol/L,则0.1mol/L的H2A溶液中c(H+)<0.12mol/L |
分析 A.二元酸(H2A)在水中第一步电离为完全电离;
B.加水稀释电离平衡正移,但氢离子浓度减小;
C.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
D.H2A溶液中第一步电离出的氢离子,抑制了第二步电离.
解答 解:A.二元酸(H2A)在水中第一步电离为完全电离,则H2A酸性较强,不是弱酸,故A错误;
B.加水稀释电离平衡正移,但氢离子浓度减小,所以稀释0.1mol/L H2A溶液,电离平衡向右移动,但是c(H+)减小,故B错误;
C.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-=H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:$\frac{(0.1+x).x}{0.1-x}$,解之得x=0.0084.所以在0.1mol•L-1的H2A溶液中,c(H+)=0.1mol/L+0.0084mol/L=0.1084mol/L,故C错误;
D.若0.1mol/L的NaHA溶液中c(H+)=0.02mol/L,0.1mol/L的H2A溶液中存在H2A═H++HA-,HA-?H++A2-,第一步电离出的氢离子,抑制了第二步电离,所以c(H+)<0.12mol/L,故D正确;
故选D.
点评 本题考查了弱电解质的电离,涉及氢离子浓度的计算、电离常数的应用等,注意该二元酸的电离方式,再结合守恒思想解答,题目难度中等.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向顺风方向的低洼处跑 | |
| B. | 用浸有纯碱液的毛巾捂住口鼻迅速逃离 | |
| C. | 向逆风方向的高处跑 | |
| D. | 来不及逃离的可用浸湿的棉被堵好门窗,并及时请求救援 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 通常状况下,NA个CO2分子占有的体积为22.4 L | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+数为0.02 NA | |
| D. | 标准状况下,22.4L 乙醇含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,28g C2H4含nA个碳碳双键 | |
| B. | 1mol丙烯酸中含有双键的数目为NA | |
| C. | 常温常压下,22.4L CCl4含有nA个CCl4分子 | |
| D. | 100ml0.1mol/L的醋酸溶液中含有的氢离子数为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 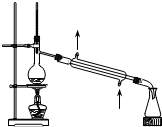 装置可用于分离苯和溴苯的混合物 | B. | 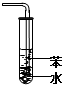 装置可用于吸收HCl或NH3气体 | ||
| C. | 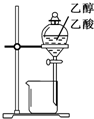 用图所示装置分离乙醇与乙酸 | D. | 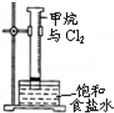 图中量筒中发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中NH4NO3只作氧化剂 | |
| B. | 每还原1mol NO3-,需氧化1mol Zn和1mol NH4+ | |
| C. | 生成的烟中含有ZnO和NH4NO3 | |
| D. | 生成的白烟是N2溶于水形成的小液滴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a (A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a (B)=a′(B) | ||
| C. | a (A)<a′(A) a (B)=a′(B) | D. | a (A)=a(A) a (B)>a′(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com