
| A. | 1s2 | B. | 3s23p4 | C. | 2s22p6 | D. | ns2np3 |
分析 A.最外层电子排布为1s2的微粒,可能为He、H-、Li+等;
B.最外层电子排布为3s23p4的微粒为S原子;
C.最外层电子排布为2s22p6的微粒,可能为Ne、Na+、F-等
D.最外层电子排布为ns2np3的微粒,不能确定元素所在周期.
解答 解:A.最外层电子排布为1s2的微粒,可能为He、H-、Li+等,不能确定形成该微粒的元素在周期表中的位置,故A错误;
B.最外层电子排布为3s23p4的微粒为S原子,属于第三周期VIA族,故B正确;
C.最外层电子排布为2s22p6的微粒,可能为Ne、Na+、F-等,不能形成该微粒的元素在周期表中的位置,故C错误;
D.最外层电子排布为ns2np3的微粒,不能确定元素所在周期,不能形成该微粒的元素在周期表中的位置,故D错误,
故选:B.
点评 本题考查核外电子排布、结构与位置关系,关键是熟练掌握常见微粒结构,难度不大,注意利用列举法与反例法进行解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | OH-、NO3-、HCO3-、Na+ | B. | Na+、SO42-、Mg2+、I- | ||
| C. | NO3-、Cu2+、K+、Cl- | D. | H+、K+、ClO-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
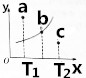 某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:| 密闭容器 | A | B | C |
| n(起始状态)/mol | 4 | 2 | 0 |
| n(平衡状态)/mol | 2.8 | 1.4 | 1.2 |
| 密闭容器 | 甲 | 乙 | 丙 | 丁 | |
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| A的平衡转化率 | 80 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
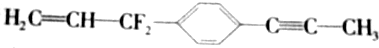 为已知结构,下列叙述中正确的是( )
为已知结构,下列叙述中正确的是( )| A. | 除苯环外的其余碳原子有可能都在同一条直线上 | |
| B. | 在同一平面上的原子最多有19个 | |
| C. | 12个碳原子不可能都在同一个平面上 | |
| D. | 12个碳原子有可能都在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D元素处于元素周期表中第二周期VIA族 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | B、D的最高价氧化物具有相似的物理性质和化学性质 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其原子最外电子层有7个电子的元素 | |
| B. | 最高正价为+3的元素 | |
| C. | 其原子最外层电子数大于电子层的元素 | |
| D. | 最高价氧化物对应的水化物是酸的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
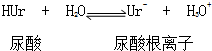 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)| A. | 反应的△H>0 | B. | 反应的△H=0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
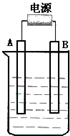 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com